-
一定温度下,向饱和NaOH溶液中加入一定量的钠块,充分反应后恢复到原来温度,下列说法正确的是
A.溶液中溶质质量增加,溶剂质量减少,溶液中溶质的质量分数变大
B.溶液的pH不变,有氢气放出
C.溶液中的Na+数目减小,有氧气放出
D.溶液中的c(Na+)增大,有氢气放出
难度: 中等查看答案及解析
-
所谓合金,就是不同种金属(也包括一些非金属)在熔融状态下形成的一种熔合物。根据下列四种金属的熔、沸点,判断其中不能形成合金的是
Na
Cu
Al
Fe
熔点/℃
97.5
1 083
660
1 535
沸点/℃
883
2 595
2 200
3 000
A.Cu和Al B.Fe和Cu C.Fe和Na D.Al和Na
难度: 中等查看答案及解析
-
下列两种气体的分子数一定相等的是
A.质量相等、密度不同的N2和C2H4 B.体积相等的CO和N2
C.等温、等体积的O2和N2 D.等压、等体积的N2和C2H4
难度: 中等查看答案及解析
-
Fe(OH)3胶体虽然是由FeCl3溶液制得,但两者是截然不同的两种物质。FeCl3溶液、Fe(OH)3胶体共同具备的性质是
A.都呈透明的红褐色
B.分散质颗粒直径相同
C.都比较稳定,密封保存一段时间都不会产生沉淀
D.当有光线透过时,都能产生丁达尔效应
难度: 中等查看答案及解析
-
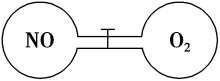
已知A是一种金属单质,B显淡黄色,其转化关系如图所示,则C的以下性质错误的是
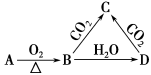
A.溶液呈碱性 B.与澄清石灰水反应产生白色沉淀
C.与足量盐酸反应放出气体 D.受热易分解
难度: 中等查看答案及解析
-
下列说法正确的是
A.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
B.1 mol Cu和足量稀HNO3反应产生NA个NO分子(NA为阿伏加德罗常数)
C.pH=1的溶液中,Fe2+、NO3-、SO42-、Na+不能大量共存
D.三氧化二铁溶于氢碘酸的离子反应为:Fe2O3+6H+=3Fe3++3H2O
难度: 中等查看答案及解析
-
已知NH3和HCl都是能用来做喷泉实验的气体。若在同温同压下用等体积烧瓶一个收集满NH3,另一个收集HCl和N2的混合气体,如图所示。喷泉实验停止后,两个烧瓶内溶液的关系是(不考虑烧瓶内溶质的扩散,氨水的溶质按NH3计算)
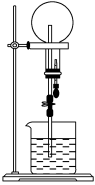
A.溶质的物质的量浓度相同、溶质的质量分数不同
B.溶质的质量分数相同、溶质的物质的量浓度不同
C.溶质的物质的量浓度和溶质的质量分数都不同
D.溶质的物质的量浓度和溶质的质量分数都相同
难度: 中等查看答案及解析
-
下列说法在一定条件下可以实现的是
①酸性氧化物与碱发生反应
②弱酸与盐溶液反应可以生成强酸
③没有水生成,也没有沉淀和气体生成的复分解反应
④两种酸溶液充分反应后的溶液体系为中性
⑤有单质参加的非氧化还原反应
⑥两种氧化物反应的产物有气体
A.①②③④⑤⑥ B.②④⑤⑥ C.①②③⑤ D.③④⑤⑥
难度: 中等查看答案及解析
-
在一定条件下,使CO和O2的混合气体26 g充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增重14 g,则原混合气体中O2和CO的质量比可能是
A.9∶4 B.1∶1 C.7∶6 D.6∶7
难度: 中等查看答案及解析
-
实验室用碳酸钠晶体配制1.00 mol·L-1的Na2CO3溶液100 mL,造成所配溶液浓度偏低的原因是
A.暴露在空气中称量碳酸钠晶体(Na2CO3·10H2O)的时间太长
B.向容量瓶转移液体时,容量瓶事先用蒸馏水洗涤
C.定容时俯视刻度线
D.洗涤液移入容量瓶中时,洒出一部分
难度: 中等查看答案及解析
-
某研究小组通过实验探究Cu及其化合物的性质,操作正确且能达到目的的是
A.将铜丝插入浓硫酸中加热,反应后把水加入反应器中,观察硫酸铜溶液的颜色
B.常温下将铜丝伸入盛满氯气的集气瓶中,观察CuCl2的生成
C.将CuCl2溶液在蒸发皿中加热蒸干,得到无水CuCl2固体
D.将表面有铜绿[Cu2(OH)2CO3]的铜器放入盐酸中浸泡,除去铜绿
难度: 中等查看答案及解析
-
下列除去杂质的方法不正确的是
A.镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥
B.用过量氨水除去Fe3+溶液中的少量Al3+
C.用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水
D.Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤
难度: 中等查看答案及解析
-
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是
①向饱和碳酸钠溶液中通入过量的CO2;
②向NaAlO2溶液中逐滴加入过量的稀盐酸;
③向AlCl3溶液中逐滴加入过量的稀氢氧化钠溶液;
④向硅酸钠溶液中逐滴加入过量的盐酸
A.①② B.①③ C.①④ D.②③
难度: 中等查看答案及解析
-
亚硝酸钠是一种防腐剂和增色剂,但在食品中过量时会对人体产生危害。其在酸性条件下会产生NO和NO2。下列有关说法错误的是
A.NaNO2既具有氧化性又具有还原性
B.食用“醋溜豆芽”可能会减少亚硝酸钠对人体的危害
C.NaNO2和胃酸作用的离子方程式为:2NO2-+2H+=NO↑+NO2↑+H2O
D.1 mol NaNO2在酸性条件下完全反应生成NO和NO2,转移电子的物质的量为1 mol
难度: 中等查看答案及解析
-
有一粗硅,含杂质铁,取等质量的样品分别投入足量的稀盐酸和足量的稀氢氧化钠溶液中,放出等量的H2,则该粗硅中铁和硅的关系正确的是
A.物质的量之比为1∶1 B.物质的量之比为1∶2
C.质量之比为4∶1 D.质量之比为2∶1
难度: 中等查看答案及解析
-
在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1 mol的混合溶液中加入0.1 mol铁粉,充分搅拌后铁完全反应,溶液中不存在Fe3+,同时析出0.1 mol Ag。则下列结论中不正确的是
A.反应后溶液中Cu2+与Fe2+的物质的量之比为1∶2
B.氧化性:Ag+>Cu2+>Fe3+>Zn2+
C.含Fe3+的溶液可腐蚀铜板
D.1 mol Fe可还原2 mol Fe3+
难度: 中等查看答案及解析
-
在一定条件下,按下列物质的量关系进行反应,其对应的离子方程式或化学方程式书写正确的是
A.n(Cl2)∶n(Fe)=5∶4 5Cl2+4Fe
2FeCl2+2FeCl3
B.n(Cl2)∶n(FeBr2)=1∶1 Fe2++2Br-+Cl2=Fe3++Br2+2Cl-
C.n(MnO4-)∶n(H2O2)=2∶3 2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O
D.n(Fe)∶n[HNO3(稀)]=1∶3 4Fe+12H++3NO3-===3Fe2++Fe3++3NO↑+6H2O
难度: 中等查看答案及解析
-
将15.6 g Na2O2和5.4 g Al同时放入一定量的水中,充分反应后得到200 mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72 L,若反应过程中溶液的体积保持不变,则下列说法正确的是
A.标准状况下,反应过程中得到6.72 L气体
B.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
C.最终得到7.8 g沉淀
D.最终得到的溶液中c(Na+)=1.5 mol·L-1
难度: 中等查看答案及解析