-
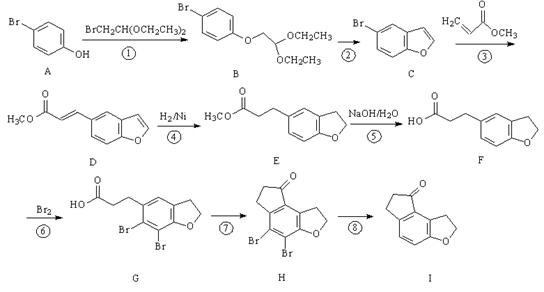
菠萝酯常用作化妆品香料,其合成方法如下:
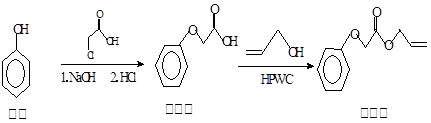
下列说法正确的是
A.原料苯酚能和NaHCO3溶液反应
B.菠萝酯可以使溴水、高锰酸钾溶液褪色
C.中间体中所有的原子都可以共平面
D.中间体和菠萝酯中均不含手性碳原子
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z是同周期中原子半径最大的元素,W的最高正价为+7价。下列说法正确的是
A.XH4的沸点比YH3高
B.X与W形成的化合物和Z与W形成的化合物的化学键类型相同
C.元素W的最高价氧化物对应水化物的酸性比Y的强
D.X与Y形成的化合物的熔点可能比金刚石高
难度: 简单查看答案及解析
-
下列根据操作和现象或目的所得出的结论正确的是
选项 操作 现象或目的 结论
A 工业上,将BaSO4浸泡在饱和Na2CO3溶液中 将BaSO4转化为BaCO3 Ksp(BaSO4)>Ksp(BaCO3)
B 向NaAlO2溶液中滴入NaHCO3 有白色沉淀 AlO结合H+能力比CO强
C 向PbO2中滴入浓盐酸 有黄绿色气体 PbO2具有还原性
D 向鸡蛋白溶液中滴入HgCl2溶液 有白色沉淀 蛋白质发生盐析
难度: 简单查看答案及解析
-
常温下,向20.00 mL 0.1000 mol·L—1 (NH4)2SO4溶液中逐滴加入0.2000 mol·L—1NaOH时,溶液的pH与所加NaOH溶液体积的关系如右下图所示(不考虑挥发)。下列说法正确的是
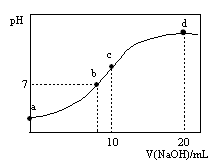
A.点a所示溶液中:c(NH
)>c(SO
)>c(H+)>c(OH-)
B.点b所示溶液中:c(NH
)=c(Na+)>c(H+)=c(OH-)
C.点c所示溶液中:c(SO
)+ c(H+)= c(NH3·H2O )+ c(OH-)
D.点d所示溶液中:c(SO
)>c(NH3·H2O )>c(OH-)>c(NH
)
难度: 简单查看答案及解析
-
N2(g)+3H2(g)
2NH3(g) △H=-92.4 kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图示。下列说法错误的是
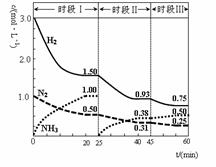
A.前20分钟反应内放出的热量为46.2kJ
B.第25分钟改变的条件是将NH3从反应体系中分离出去
C.若第60分钟时反应又达到了平衡,则时段Ⅲ改变的条件是降低温度
D.时段Ⅰ仅将初始投放的物质浓度增至原来的2倍,则反应物的转化率增大,平衡常数不变
难度: 简单查看答案及解析
-
化学与生命、材料、能源等科学密切联系。下列有关化学发展方向的说法不正确的是
A.研究新药物,预防和治疗人类的疾病
B.研究高效、高残留农药,提高粮食产量
C.开发光电转换材料,充分利用太阳能
D.开发高效的模拟酶催化剂,减少对化肥的依赖
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A.Be原子的结构示意图:
B.乙酸的结构简式:
C.中子数为16的硫原子:
S
D.NH4Cl的电子式:
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mol·L-1的NaI溶液:K+、H+、SO
、NO
B.0.1 mol·L-1的NaHCO3溶液:K+、Na+、NO
、Cl-
C.0.1 mol·L-1 FeCl3溶液:K+、Na+、ClO-、Cl-
D.0.1 mol·L-1的氨水:Cu2+、Na+、SO
、NO
难度: 简单查看答案及解析
-
2HI(g)
H2(g)+I2(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是
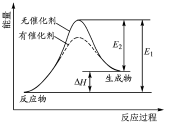
A.该反应为放热反应
B.升高温度,不影响活化分子百分数
C.催化剂能降低该反应的活化能
D.逆反应的活化能等于正反应的活化能
难度: 简单查看答案及解析
-
下列有关物质的性质与应用不相对应的是
A.CaH2能与水反应生成H2,可用作野外制氢气
B.NH3具有还原性,可与灼热的CuO反应制备少量氮气
C.SO2具有还原性,可使酸性高锰酸钾溶液褪色
D.Si能导电,可用于制作光导纤维
难度: 简单查看答案及解析
-
下列有关实验装置进行的相应实验,能达到实验目的的是




图1 图2 图3 图4
A.用图1所示装置进行稀硝酸与铜的反应制取并收集NO
B.用图2所示装置进行用已知浓度的氢氧化钠溶液测定盐酸浓度的实验
C.用图3所示装置制取少量Cl2
D.用图4所示装置检验电流的方向
难度: 简单查看答案及解析
-
下表各组物质之间通过一步反应不可以实现如下图所示转化关系的是
选项 X Y Z 箭头上所标
数字的反应条件
A SiO2 Na2SiO3 H2SiO3 ①与Na2CO3熔融
B NaCl NaHCO3 Na2CO3 ②加热
C N2 NO2 HNO3 ③加热
D C CO CO2 ④灼热炭粉
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.1 L 0.1 mol·L-1的氨水中含有的NH3·H2O分子数为0.1 NA
B.电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2 NA
C.标准状况下,2.24 L的二氯甲烷中含有的碳氯共价键的数目为0.2 NA
D.一定条件下,4.6 g NO2和N2O4混合气体中含有的N原子数目为0.1 NA
难度: 简单查看答案及解析
-
下列表示对应化学反应的离子方程式不正确的是
A.FeCl3溶液与Cu的反应:Cu+2Fe3+=Cu2++2Fe2+
B.向NaClO溶液中加入浓盐酸:ClO
+Cl
+2H+=Cl2↑+ H2O
C.用氨水溶解Cu(OH)2:Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH
+4H2O
D.向NH4HCO3中滴加少量的NaOH溶液:NH
+OH
=NH3·H2O+H2O
难度: 简单查看答案及解析
-
下列有关说法正确的是
A.一定条件下,使用催化剂能加快反应速率但不能改变平衡转化率
B.氢氧燃料电池的能量转换形式仅为化学能转化为电能
C.在NH4HSO4溶液中由于NH4+的水解促进了水的电离,所以水的电离程度增大
D.在一密闭容器中发生2SO2+O2
2SO3反应,增大压强,平衡会正向移动,
的值增大
难度: 简单查看答案及解析
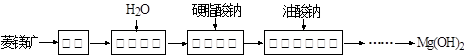
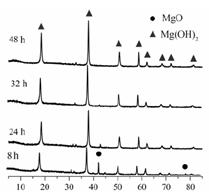


 已知:盐基度=n(OH-)/3n(Fe)×100% 。式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量。所得产品若要用于饮用水处理,需达到盐基度指标为 8.0%~16.0%。
已知:盐基度=n(OH-)/3n(Fe)×100% 。式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量。所得产品若要用于饮用水处理,需达到盐基度指标为 8.0%~16.0%。