-
下列物质中,不属于“城市空气质量日报”报道内容的是( )
A.二氧化硫 B.氮氧化物 C.二氧化碳 D.悬浮颗粒
难度: 简单查看答案及解析
-
生物学家借助新的显微技术,成功观察到小于200纳米的粒子。下列分散系中,分散质粒子半径最小的是( )
A.雾 B.Fe(OH)3胶体 C.石灰乳 D.KNO3溶液
难度: 简单查看答案及解析
-
下列物质的水溶液能导电,但属于非电解质的是( )
A.SO3 B.Cl2 C.NH4NO3 D.HNO3
难度: 简单查看答案及解析
-
下列化学用语正确的是:( )
A.Cl-的结构示意图:
B.光导纤维主要成分的化学式:Si
C.1H2、2H2、3H2互为同位素
D.质子数为53,中子数为78的碘原子:131 53I
难度: 简单查看答案及解析
-
设NA代表阿伏伽德罗常数,下列说法正确的是( )
A.100g质量分数为98%的H2SO4中所含的氧原子的物质的量为4NA
B.标准状况下,11.2L H2O中含有的原子数为1.5NA
C.常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3 NA
D.标准状况下,22.4L氦气与22.4L氯气所含原子数均为2NA
难度: 简单查看答案及解析
-
下列关于0.15mol /L的Na2SO4溶液的说法中,正确的是( )
A.1L溶液中含有Na+、SO42-总数为0.3NA
B.1L溶液中含有Na+数目是0.15NA
C.1 L溶液中Na+的浓度是0.3 mol / L
D.2 L溶液中含有SO42—的浓度是0.3mol / L
难度: 简单查看答案及解析
-
下列各微粒中,核外电子总数相等的是( )
A.Na和Na+ B.NH4+和H3O+ C.N2和CO2 D.H2S和H2O
难度: 简单查看答案及解析
-
下列关于浓硫酸的叙述正确的( )
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D.浓硫酸在常温下能够使铁、铝等金属钝化
难度: 简单查看答案及解析
-
下列试剂的保存或使用正确的是( )
A.实验室的浓硝酸需要保存在棕色试剂瓶中
B.漂白粉比氯水稳定,可露置在空气中
C.称量氢氧化钠固体时,可在天平两个托盘上各放一张等质量的纸,左边纸上放NaOH,右边纸上放砝码
D.氢氟酸应密封保存在玻璃瓶中
难度: 简单查看答案及解析
-
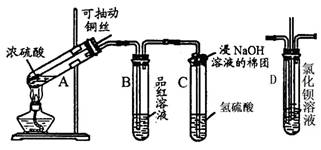
下列实验装置图所示的实验操作,正确的是( )

难度: 简单查看答案及解析
-
往浅绿色的Fe(NO3)2溶液中逐滴加入稀盐酸,溶液的颜色变化是( )
A.颜色变浅 B.变为绿色 C.没有改变 D.变为棕黄色
难度: 简单查看答案及解析
-
实验室中要使Al2(SO4)3溶液中的Al3+全部沉淀出来,最适宜的试剂是( )
A.NaOH溶液 B.氨水 C.Ba(OH)2溶液 D.盐酸
难度: 简单查看答案及解析
-
标准状况下,等质量的SO2和CO2相比较,下列叙述正确的是( )
A.密度比为16:11 B.体积比为16:11 C.密度比为11:16 D.体积比为1:1
难度: 简单查看答案及解析
-
等质量的钠进行下列实验,最终生成氢气最多的是( )
A.将钠投入到足量水中 B.将钠用铝箔包好并刺一些小孔,再投入足量水中
C.将钠投入足量稀硫酸中 D.将钠投入足量饱和食盐水中
难度: 简单查看答案及解析
-
下列物质中,既能跟稀硫酸反应,又能跟NaOH溶液反应的是( )
①Al2O3;②Mg(OH)2;③Al(OH)3;④(NH4)2CO3;⑤NaHCO3;⑥AlCl3
A.①③⑤⑥ B.只有①③ C.只有②③ D.①③④⑤
难度: 简单查看答案及解析
-
下列除杂质(括号中物质为杂质)所用试剂或方法不正确的是( )
A.CO2(CO):O2 B.MgO (Al2O3):NaOH溶液
C.NaHCO3溶液(Na2CO3):过量的CO2 D.CO2(HCl):饱和NaHCO3溶液
难度: 简单查看答案及解析
-
下列物质的变质过程中,既有氧化还原反应,又有非氧化还原反应的是( )
A.Ca(ClO)2 B. NaOH C.FeSO4 D.Na2SO3
难度: 简单查看答案及解析
-
下列反应需要加入还原剂才能实现的是( )
A. Fe2+ →Fe3+ B. SO32- →SO42- C. CO32-→ CO2 D. MnO4- → Mn2+
难度: 简单查看答案及解析
-
在氯化铁、氯化铜和盐酸的混合溶液中加入铁粉,待反应结束,所剩余的固体滤出后能被磁铁吸引,则反应后溶液存在较多的阳离子是( )
A.Cu2+ B.Fe3+ C.Fe2+ D.H+
难度: 简单查看答案及解析
-
将0.15mol MnO2和50ml 12mol·L-1浓盐酸混合后缓慢加热,充分反应可制得氯气的物质的量为( )
A.等于0.15mol B.大于0.15mol C.小于0.15mol D.以上结论都不对
难度: 简单查看答案及解析
-
某强酸性溶液中含有Fe3+、Mg2+,在此溶液中还能存在的离子组是( )
A.K+、Na+、HCO3-、SO42- B.OH-、K+、Cu2+、NO3-
C.K+、SCN-、I-、Na+ D.K+、SO42-、Na+、NO3-
难度: 简单查看答案及解析
-
下列离子方程式正确的是( )
A.大理石溶于稀盐酸中::2H++CO3 2-=H 2O+CO2↑
B.铝离子与过量氨水反应:Al3++4NH3·H2O=AlO2-+2H 2O+4NH4+
C.二氧化硅与氢氧化钠溶液反应 SiO2+2OH-=SiO32-+H2O
D.硫酸铜与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓
难度: 简单查看答案及解析
-
可以用来判断碳酸氢钠粉末中混有碳酸钠的实验方法是( )
A.加热时有无色气体放出
B.滴加盐酸时有气泡产生
C.溶于水后,滴加CaCl2溶液,有白色溶液生成
D.溶于水后,滴加澄清石灰水,有白色溶液生成
难度: 简单查看答案及解析
-
有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则溶液中Cl-与SO42-之比为( )
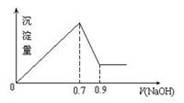
A.2∶3 B.1∶3 C.3∶2 D.2∶1
难度: 简单查看答案及解析
-
现有2mol/L的盐酸和硫酸各100mL,分别加入等质量的铁粉,反应结束时,所生成的气体的质量比为2:3,则往酸中加入的铁粉的质量为( )
A.8.4 g B.5.6 g C.2.8 g D.16.8g
难度: 简单查看答案及解析