-
关于氮族元素(从N到Bi)单质及其化合物的性质递变规律说法正确的是( )
A.单质的熔、沸点依次增大 B.单质磷的化学活泼性比氮气强
C.气态氢化物的还原性依次减弱 D.磷酸的酸性比硝酸强
难度: 简单查看答案及解析
-
下列分子中,属于极性分子的是( )
A.N2 B.O2 C.NH3 D.CO2
难度: 简单查看答案及解析
-
在2A+B
3C+4D反应中,表示该反应速率最快的是( )
A. υ(A)= 0.5 mol/(L·s) B. υ(B)= 0.3 mol/(L·s)
C. υ(C)= 0.8 mol/(L·s) D. υ(D)= 1 mol/(L·s)
难度: 简单查看答案及解析
-
第ⅡA族中的铍与铝性质相似,下列有关铍及其化合物的叙述错误的是( )
A.单质铍可与NaOH溶液反应生成H2 B.Na2BeO2溶液能与盐酸反应
C.氢氧化铍易溶于水 D.氧化铍能溶于NaOH溶液
难度: 简单查看答案及解析
-
下列不属于铵盐的共同性质的是( )
A.受热分解都产生氨气 B.都易溶于水
C.与火碱工业产生氨气 D.都是晶体
难度: 简单查看答案及解析
-
一定条件下反应2AB(g)
A2(g)+B2(g)达到平衡状态的标志是( )
A.容器中各组分的体积分数不随时间变化
B.容器内,3种气体AB、A2、B2共存
C.AB的消耗速率等于A2的消耗速率
D.单位时间内生成n molA2,同时消耗2n molAB
难度: 简单查看答案及解析
-
在温度压强不变的情况下,已知N2O4 2NO2,2mol N2O4在密闭容器内分解成NO2,到达平衡时生成了0.6mol NO2,则平衡时气体的总物质的量是( )
A.0.6mol B.1.8mol C.2.2mol D.2.3mol
难度: 简单查看答案及解析
-
下列叙述中,错误的是( )
A.硝酸一般盛放在棕色试剂瓶中
B.可用硫氰化钾溶液检验Fe2+的存在
C.造成光化学烟雾的主要气体是NO2
D.可用电解MgCl2的方法制取单质镁
难度: 简单查看答案及解析
-
将2.6g金属混合物的粉末跟足量的盐酸反应,生成2.24 L H2(标况),则此金属混合物可能是( )
A. Mg和Al B. Al和Fe C. Fe和Zn D. Zn和Cu
难度: 简单查看答案及解析
-
在强酸性溶液中能大量共存的是( )
A. NH4+ Fe2+ SO42- NO3- B. K+ Na+ S2- AlO2-
C. K+ NH4+ Cl- SO42- D. Na+ K+ NO3- HCO3-
难度: 简单查看答案及解析
-
将铜粉放入稀硫酸中,加热无明显反应发生,但加入某盐后,发现铜粉质量逐渐减少,该盐可能是( )
A.FeSO4 B.ZnSO4 C.KNO3 D.NaCl
难度: 简单查看答案及解析
-
反应C(s)+H2O(g) CO(g)+ H2(g)在一可变容积的密闭容器中进
行,在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是( )
A.增加CO的物质的量
B.将容器的体积缩小一半
C.保持压强不变,充入N2使容器体积变大
D.保持体积不变,充入N2使体系压强增大
难度: 简单查看答案及解析
-
对于可逆反应mA(g)+nB(g) pC(g)+qD(g) 满足下列图象,根据下列图象判断的四种关系正确的是( )
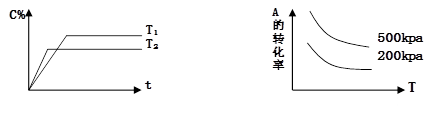
A. m+n>p+q,正反应吸热 B. m+n>p+q,正反应放热
C. m+n<p+q, 正反应放热 D. m+n<p+q,正反应吸热
难度: 简单查看答案及解析
-
铁与稀HNO3反应时,若消耗的Fe与HNO3的物质的量之比为4:10,且只生成Fe2+,则反应中生成的还原产物是( )
A.N2 B.NO2 C.NO D.N2O
难度: 简单查看答案及解析
-
温度一定时, 于密闭容器中发生可逆反应: mA(g) + nB(g)
pC(g), 达到平衡后, 若将混合气体的体积压缩到原来的一半, 当再次达到平衡时, C的浓度为原平衡时C的浓度的 1.9 倍, 则下列叙述中正确的是( )
A. 平衡向逆反应方向移动 B. 气体C的体积分数增大
C. 气体A的转化率升高 D. m + n > p
难度: 简单查看答案及解析