-
下列表示物质结构的化学用语或模型图正确的是
A.H2O2的电子式:
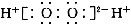 B.CH4的球棍模型:
B.CH4的球棍模型: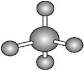
C.
的原子结构示意图:
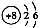 D.CCl4的结构式:
D.CCl4的结构式: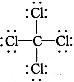
难度: 中等查看答案及解析
-
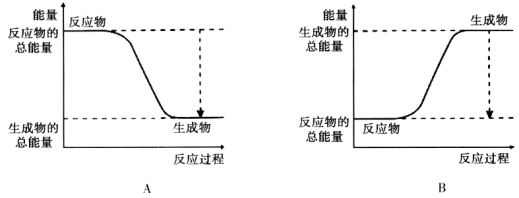
为解决日益加剧的温室效应等问题,科学家正在研究建立如下图所示的二氧化碳新循环体系:
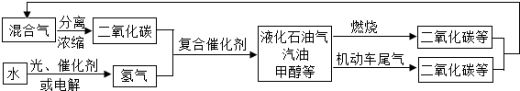
上述关系图能反映的化学观点或化学思想有:( )
①化学变化中元素种类是守恒的;②燃烧时化学能可以转化为热能和光能;③光能或电能可以转化为化学能;④无机物和有机物可以相互转化;⑤二氧化碳也是一种重要的资源.A.①②③ B.①②④⑤ C.①④⑤ D.①②③④⑤
难度: 中等查看答案及解析
-
下表物质与其所含化学键类型、所属化合物类型完全正确的一组是
选 项
A
B
C
D
物 质
CO2
MgCl2
HCl
NaOH
所含化学键类型
共价键
离子键、共价键
离子键
离子键、共价键
所属化合物类型
共价化合物
离子化合物
离子化合物
共价化合物
难度: 中等查看答案及解析
-
X、Y、Z均是短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z- ,
Y+和Z-离子具有相同的电子层结构。下列说法不正确的是( )
A. 原子最外层电子数:Z>X>Y B. 氢化物的稳定性:Z>X
C. 离子半径:X2->Y+>Z- D. 原子序数:X>Y>Z
难度: 中等查看答案及解析
-
下列说法正确的是:
A.医用酒精的浓度通常为95%
B.单质硅是将太阳能转化为电能的常用材料
C.淀粉、纤维素和油脂都属于天然高分子化合物
D.合成纤维和光导纤维都是新型无机非金属材料
难度: 简单查看答案及解析
-
下表中所列的都是烷烃,它们的一卤取代物均只有一种,分析下表中各项的排布规律,按此规律排布第6项应为( )
1
2
3
4
5
……
CH4
C2H6
C5H12
C8H18
……
……
A.C14H30 B.C17H36 C.C20H42 D.C26H54
难度: 中等查看答案及解析
-
在一定温度下,10 mL 0.40mol/LH2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。下列叙述不正确的是(溶液体积变化忽略不计)
t/min
0
2
4
6
8
10
V(O2)/mL
0.0
9.9
17.2
22.4
26.5
29.9
A.0~6 min的平均反应速率:v(H2O2)≈3.3×10-2 mol/(L·min)
B.6~10 min的平均反应速率:v(H2O2)<3.3×10-2 mol/(L·min)
C.反应到6 min时,c(H2O2)=0.30mol/L
D.反应到6 min时,H2O2分解了50%
难度: 中等查看答案及解析
-
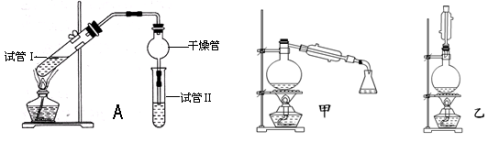
实验室制备,收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器口顺序为a接( )接( )接( )接( )接f(填接口字母) ( )
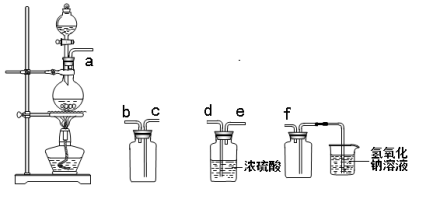
A.b c d e B.d e b c C.d e c b D.e d b c
难度: 中等查看答案及解析
-
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“ · ”代表一种元素,其中O点代表氢元素.下列说法中错误的是
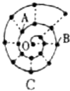
A.离O点越远的元素原子半径越大
B.虚线相连的元素处于同一族,A元素位于元素周期表ⅥA族
C.B元素是图中金属性最强的元素
D.B、C最高价氧化物的水化物可以相互反应
难度: 中等查看答案及解析
-
在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应A(s)+2B(g)
C(g)+D(g)已达到平衡状态①各气体物质的物质的量浓度②气体的总物质的量③混合气体的压强④混合气体的密度
A.只有①② B.只有①④ C.只有①③④ D.①②③④
难度: 中等查看答案及解析
-
甲—辛等八种元素在周期表中的相对位置如下表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断不正确的是
A.乙的单质在空气中燃烧生成只含离子键的化合物
B.原子半径:辛>己>戊
C.丙与庚的原子核外电子数相差13
D.最高价氧化物的水化物的碱性:丙>乙>甲
难度: 中等查看答案及解析
-
巴豆酸的结构简式为CH3—CH=CH—COOH。现有①氯化氢、②溴水、③纯碱溶液、④乙醇、⑤酸性高锰酸钾溶液,判断在一定条件下,能与巴豆酸反应的物质是
A.只有②④⑤ B.只有①③④ C.只有①②③④ D.全部
难度: 中等查看答案及解析
-
下列关于苯的叙述正确的是
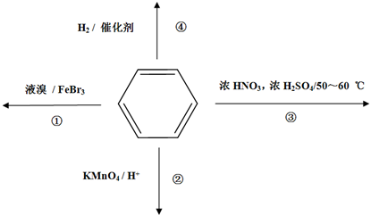
A.反应①常温下能进行,其有机产物为
B.反应②不发生,但是仍有分层现象,紫色层在下层
C.反应③为加成反应,产物是三硝基甲苯
D.反应 ④中1mol苯最多与3 mol H2发生加成反应,是因为苯分子含有三个碳碳双键
难度: 中等查看答案及解析
-
下列实验不能获得成功的是 ( )
实验目的
实验步骤
A.
探究催化剂对化学反应速率的影响
向H2O2溶液中滴加少量FeCl3溶液
B.
探究乙醇能发生氧化反应
将铜丝在酒精灯加热后,立即伸入无水乙醇中
C.
探究石蜡油分解的产物不都是烷烃
将石蜡油加强热产生的气体通入溴的四氯化碳溶液中
D.
探究蔗糖水解的产物中是否含有葡萄糖
取少量蔗糖溶液加稀硫酸,水浴加热几分钟后,再加入新制的氢氧化铜悬浊液并且加热
难度: 中等查看答案及解析
-
现有一包铝热剂是铝粉和氧化铁(Fe2O3)粉末的混合物,在高温下使之充分反应,将反应后的固体分为两等份,进行如下实验(假定反应前后溶液的体积不变):
①向其中一份固体中加入100 mL 2.0mol•L-1的NaOH溶液,加热使其充分反应后过滤,测得溶液中的c(OH-)=1mol•L-1
②向另一份固体中加入100 mL 4.0 mol•L-1的HCl溶液,使固体全部溶解,测得反应后所得溶液中只有H+、Fe2+和Al3+三种阳离子且c(H+)=0.1mol•L-1则产生的气体的体积(标准状况)为 ( )
A.2.856L B.2.448L C.2.688L D.2.352L
难度: 中等查看答案及解析
-
铝土矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼
金属铝。下列说法不正确的是( )
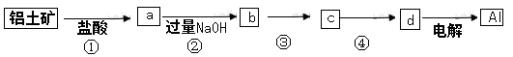
A.①、②中除加试剂外,还需要进行过滤操作
B.a、b中铝元素的化合价相同
C.③中需要通入过量的氨气
D.④进行的操作是加热,而且d一定是氧化铝
难度: 中等查看答案及解析