-
下列材料都具有一定的特殊性能,其中是由主族元素和副族元素形成的是( )
A.透明陶瓷材料硒化锌 B.超导材料K3C60
C.半导体材料砷化镓 D.吸氢材料镧镍合金
难度: 简单查看答案及解析
-
l3C—NMR(核磁共振)、15N—NMR可用于测定蛋白质、核酸等生物大分子的空间结构,下面有关13C、15N叙述正确的是( )
A.13C与15N有相同的中子数 B.13C与C60互为同素异形体
C. 15N与14N互为同位素 D.15N的核外电子数与中子数相同
难度: 简单查看答案及解析
-
下列反应既属于氧化还原反应,又属于吸热反应的是( )
A.铝片与稀盐酸反应 B.灼热的炭与二氧化碳反应
C.硫在氧气中燃烧 D.Ba(OH)2·8H2O与NH4Cl反应
难度: 简单查看答案及解析
-
下列各项表达式错误的是( )
A.氧元素的一种核素:
B.过氧化钠的电子式:
C.二氧化碳分子的结构式:O-C-O D.F- 的结构示意图:
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.非金属原子间以共价键结合的物质都是共价化合物
B.制催化剂的材料和制耐高温、耐腐蚀的合金材料可在过渡元素中寻找
C.1mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热
D.铷的熔点比钠低,其硫酸盐易溶于水
难度: 简单查看答案及解析
-
X、Y都是短周期元素,X原子最外层只有一个电子,Y元素的最高正价与最低负价的代数和为6,X和Y两元素形成的化合物为R,下列叙述正确的是 ( )
A.R一定是气态 B.R一定是离子化合物
C.R一定是共价化合物 D.R可能是离子化合物,也可能是共价化合物
难度: 简单查看答案及解析
-
下列各组性质比较中,正确的是( )
①酸性:HClO4>HBrO4>HIO4 ②离子还原性:S2->Cl->Br ->I- ③沸点:HF>HCl>HBr>HI
④金属性:K>Na>Mg>Al ⑤气态氢化物稳定性:HF>HCl>H2S ⑥半径:O2->Na+>Na>Cl
A.①②③ B.②③④ C.①④⑤ D.①②③④⑤⑥
难度: 简单查看答案及解析
-
阴离子
含N个中子,X的质量数为A,则ag X的氢化物含质子的物质的量是( )
A.
mol B.
mol
C.
mol D.
mol
难度: 简单查看答案及解析
-
有M、N、P、Q四块金属片,进行如下实验,①M、N用导线相连后,同时插入稀H2SO4中,M极为负极 ②P、Q用导线相连后,同时浸入稀H2SO4中,电子由P→导线→Q ③M、P相连后,同时浸入稀H2SO4,P极产生大量气泡 ④N、Q相连后,同时浸入稀H2SO4中,Q极发生氧化反应,则四种金属的活动性顺序为:( )
A.M>N>P>Q B.P>M>N>Q C.N>Q>P>M D.M>P>Q>N
难度: 简单查看答案及解析
-
下列说法中,不正确的是( )
A.双原子分子中的共价键,一定是极性键
B.非极性键也可能存在于离子化合物中
C.物理变化可能破坏化学键
D.离子化合物在固态时不能导电
难度: 简单查看答案及解析
-
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间(t)产生气体体积(V)的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是( )
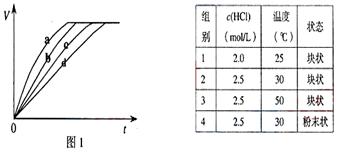
A.3-4-1-2 B.1-2-4-3 C.4-2-3-1 D.3-4-2-1
难度: 简单查看答案及解析
-
参照反应Br + H2 → HBr + H的能量对反应历程的示意图,下列叙述中正确的是( )
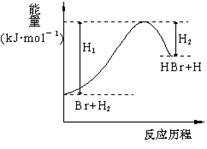
A.正反应为放热反应
B.断键吸收的总能量大于成键放出的总能量
C.反应物总能量高于生成物总能量
D.升高温度可增大正反应速率,降低逆反应速率
难度: 简单查看答案及解析
-
可逆反应N2(g)+3H2(g)
2NH3(g)在体积不变的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol N2的同时,生成3n mol H2
②断开1mol H-H键的同时断开2 molN-H键
③用N2、H2、NH3的浓度变化表示的反应速率之比为1:3:2
④混合气体的压强不再改变
⑤混合气体的密度不再改变
A.②④ B.①④ C.①③④ D.②③④⑤
难度: 简单查看答案及解析
-
右图是周期表中短周期的一部分,X、Y、Z三种元素原子核外电子数之和等于Y的质量数,Y原子核内质子数与中子数相等,下列叙述不正确的是 ( )
A.X元素最高价氧化物对应的水化物具有强氧化性和不稳定性
B.Y元素的常见氧化物、气态氢化物的水溶液均是酸
C.Z元素的单质能与水剧烈反应
D.X、Y、Z的最高价含氧酸及气态氢化物的水溶液都是强酸
难度: 简单查看答案及解析
-
对于反应A2 (g)+ 3B2(g)
2C(g),以下表示其化学反应速率最快的是( )
A.v(A2) =0.4mol/(L?s) B.v(B2) =0.8mol/(L?s)
C.v(C) =0.6mol/(L?s) D.v(B2) =4.2mol/(L?min)
难度: 简单查看答案及解析
-
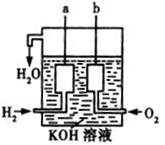
人造地球卫星用到的一种高能电池——银锌蓄电池,其电极分别是Ag2O和Zn,电解液是KOH溶液。该电池的电极反应式为Zn+2OH--2e-=Zn(OH)2,Ag2O+H2O+2e-=2Ag+2OH-。下列说法中正确的是( )
①锌为负极,Ag2O为正极;②放电时,正极附近溶液OH-浓度增大;③工作时电流由Ag2O极经外电路流向Zn极;④溶液中阴离子向正极方向移动,阳离子向负极方向移动
A.① B.①②④ C.①②③ D.①②③④
难度: 简单查看答案及解析
-
将4mol A气体和2mol B气体在2L的密闭容器中混合,并在一定条件下发生如下可逆反应:2A(g) + B(g)
2C(g)。若经2s后测得C的浓度为0.6 mol/L,现有下列几种说法,其中正确的是( )
A.反应达到平衡时,A、B、C的浓度不再变化,反应停止
B.升高温度、增大压强、增加A的浓度、减小C的浓度或使用催化剂等都可以使反应速率加快
C.经过足够长时间后,A和B可以完全转化为C
D.2s时物质A转化了1.2mol
难度: 简单查看答案及解析
-
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中滴入浓CuSO4溶液,一段时间后,下列有关判断正确的是(实验中,不考虑两球的浮力变化)( )
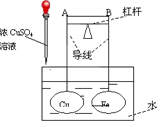
A.杠杆为导体或绝缘体时,均为A端高B端低
B.杠杆为导体或绝缘体时,均为A端低B端高
C.当杠杆为导体时,A端低B端高;杠杆为绝缘体时,A端高B端低
D.当杠杆为导体时,A端高B端低;杠杆为绝缘体时,A端低B端高
难度: 简单查看答案及解析