-
我国决定推广使用车用乙醇汽油,它是在汽油中加入适量的乙醇形成的混合燃料。
下列叙述错误的 ( )
A.使用乙醇汽油能减少有害气体的排放
B.乙醇汽油是一种新型化合物
C.燃料中的乙醇可以通过粮食发酵或化工合成等方法制得
D.乙醇汽油的推广使用可以缓解石油资源短缺对经济发展造成的压力
难度: 简单查看答案及解析
-
下列有关表达正确的是( )
A.硫离子的电子排布式:1s22s22p63s23p4
B.N原子最外层电子的轨道表示式:
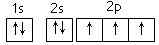
C.CO2分子的结构式: O=C=O
D.2-甲基-1-丙醇的结构简式:
难度: 简单查看答案及解析
-
被誉为“光纤之父”的华人科学家高锟荣获2009年诺贝尔化学奖。下列叙述错误的是( )
A.SiO2是生产光导纤维的主要原料
B.SiO2与CO2(干冰)的晶体结构不同
C.干冰和SiO2固体熔化时破坏的作用力是相同的
D.二氧化硅晶体中不存在SiO2分子,因为它含有类似金刚石的空间网状结构
难度: 简单查看答案及解析
-
下列各组物质的分类,正确的是( )
A.同位素:金刚石、石墨 B.非极性分子:H2O、NH3
C.同系物:
-OH、
-CH2OH D.同分异构体:HCOOCH3、HOCH2CHO
难度: 简单查看答案及解析
-
下列关于化学学习和研究的说法错误的是( )
A. 能量的变化一定会引起化学反应的变化
B. 化学反应一定会引起化学键的变化
C. 化学模型的建立有助于解释一些化学现象
D. 化学基本原理的应用是建立在有一定条件的基础上的
难度: 简单查看答案及解析
-
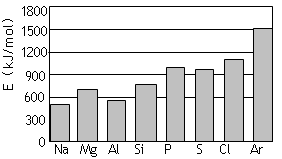
0.4mol金属钠投入到足量的CH3CH2OD中,则生成的气体中含有 ( )
A.0.2mol中子 B.0.4mol电子 C.0.2mol质子 D.0.4mol分子
难度: 简单查看答案及解析
-
下列说法正确的是 ( )
A. 决定原子种类的微粒是质子
B. 氢的三种同位素:H、D、T,氯有两种同位素: 35Cl、37Cl;当组成氯化氢分子时,
其分子量所得的数值最多有6种
C. 若某元素原子的质量是ag,12C原子的质量为bg, 则该原子的相对原子质量是
D. 铷有两种同位素85Rb和87Rb, 已知铷元素的近似相对原子质量为85.5,
则85Rb 的质量百分含量是75%
难度: 简单查看答案及解析
-
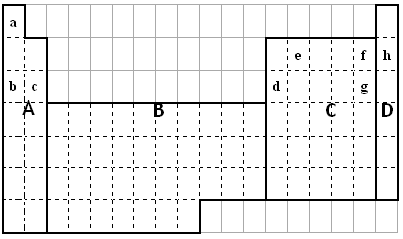
关于硫原子核外电子的叙述错误的是( )
A.排布在K、L、M三个电子层上 B.3p亚层上有2个空轨道
C.共有16种不同的运动状态 D.共有5种不同能量的电子
难度: 简单查看答案及解析
-
以下性质的比较中,正确的是( )
A.最高正价:F>O>N B. 原子半径:P> N > O
C.熔点:Mg>Na>Li D.密度:苯>水>四氯化碳
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. ⅠA族元素的金属性比ⅡA族元素的金属性强
B . ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
C. 若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q
D. 第三周期元素的离子半径从左到右逐渐减小
难度: 简单查看答案及解析
-
有关物质结构的叙述正确的是( )
A.晶体中只要有阳离子就一定有阴离子
B.由电子定向移动而导电的物质一定是金属晶体
C.晶体中一定存在作用力,但不一定存在化学键
D.在离子化合物中不可能存在非极性共价键
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 两种元素组成的分子中一定只有极性键
B. 原子晶体中共价键越强,熔点越高
C. 晶体中分子间作用力越大,分子越稳定
D. 由极性共价键结合的分子一定是极性分子
难度: 简单查看答案及解析
-
由2—氯丙烷制取少量的1,2—丙二醇
时,
需要经过下列哪几步反应( )
A.消去、加成、消去 B.加成、消去、取代
C.取代、消去、加成 D.消去、加成、取代
难度: 简单查看答案及解析
-
某有机物的结构如图所示。下列叙述中正确的是 ( )

A. 该物质可以视为酚类
B. 在浓硫酸作用下,分子内消去一个水分子,产物有三种同分异构体
C. 能使溴的四氯化碳溶液褪色
D. 该物质不能发生氧化反应
难度: 简单查看答案及解析
-
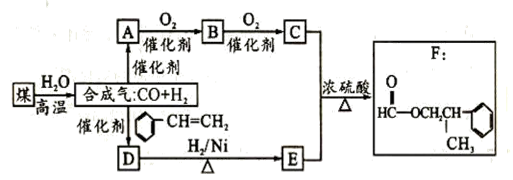
食品香精菠萝酯的生产路线(反应条件略去)如下:
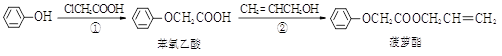
下列叙述错误的是( )
A. 步骤①产物中残留的苯酚可用FeCl3溶液检验
B. 步骤②产物中残留的CH2=CHCH2OH可用溴水检验
C. 苯酚和菠萝酯均可与酸性KMnO4溶液发生反应
D. 苯氧乙酸和菠萝酯均可与H2在一定条件下发生反应
难度: 简单查看答案及解析
-
从甜橙的芳香油中可分离得到如下图结构的化合物:现在试剂:

①KMnO4酸性溶液; ②H2/Ni; ③Ag(NH3)2OH; ④新制Cu(OH)2,
能与该化合物中所有官能团都发生反应的试剂有( )
A ①② B ②③ C ③④ D ①④
难度: 简单查看答案及解析
-
某有机物A是农药生产中的一种中间体,其结构简式为:
关于A的叙述正确的是( )
A.属于芳香烃
B.易溶于水
C.1molA与足量的NaOH溶液反应,最多可以消耗3mol NaOH
D.浓硫酸加热条件下可发生消去反应
难度: 简单查看答案及解析
-
分析下列各物质的物理性质,可判断其固态不属于分子晶体的是( )
A.碳化铝,黄色晶体,熔点2200℃.熔融态不导电
B.溴化铝,无色晶体,熔点98℃,熔融态不导电
C.五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿中
D.溴化钾,无色晶体,熔融时或溶于水中都能导电
难度: 简单查看答案及解析
-
下列物质性质的变化规律与分子间作用力有关的是 ( )
A.HF、HCl、HBr的热稳定性依次减弱
B.金刚石的硬度大于硅,其熔、沸点也高于硅
C.NaF、NaCl、NaBr的熔点依次降低
D.F2、Cl2、Br2、I2的熔、沸点逐渐升高
难度: 简单查看答案及解析
-
下列有关除去杂质(括号内为杂质)的操作中错误的是( )
A. 苯(苯酚):加浓溴水后,过滤
B. 乙烷(乙烯):催化加氢
C. 乙酸乙酯(乙酸):加饱和碳酸钠溶液后,分液
D.乙醇(水):加新制生石灰,蒸馏
难度: 简单查看答案及解析
-
麦考酚酸是一种有效的免疫抑制剂,能有效地防止肾移植排斥,其结构简式如图所示。 下列有关麦考酚酸说法正确的是( )
A.分子结构中含有4个碳碳双键
B.1 mol麦考酚酸最多能和5 mol H2发生加成反应
C.麦考酚酸可以与浓溴水发生取代反应
D.1 mol麦考酚酸与足量的NaOH溶液反应,最多可以消耗3mol NaOH
难度: 简单查看答案及解析
-
家用管道煤气的成分是CO、H2、CH4,10 L这种管道煤气充分燃烧,生成CO2和H2O, 同温同压下消耗空气50 L(空气中氧气的体积分数为0.2)。 则该管道煤气中CO、H2、CH4的体积之比可能是 ( )
A.1:1:1 B.3:5:4
C.2:4:5 D.1:6:4
难度: 简单查看答案及解析