-
下列有关物质分类正确的是
A.CuO、MgO、Na2O2均属于碱性氧化物
B.次氯酸、醋酸、氨气均属于弱电解质
C.C60、CCl4、蛋白质均属于有机物
D.液氯、晶体硅、臭氧均属于单质
难度: 中等查看答案及解析
-
下列有关说法中,不正确的是
A.焰火的五彩缤纷是某些金属元素的性质的展现
B.SiO2可用于制造光导纤维,其性质稳定,不溶于强酸、强碱
C.“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关
D.根据分散质微粒直径大小可以将分散系分为溶液、胶体和浊液
难度: 中等查看答案及解析
-
在水溶液中能大量共存的一组离子是
A.NH+、Na+、Cl-、SO42- B.K+、Mg2+、OH-、NO3-
C.H+、Ca 2+、SiO32-、NO3- D.K+、Al3+、ClO-、HCO3-
难度: 中等查看答案及解析
-
下列做法正确的是
A.硝酸保存在带橡胶塞的棕色细口瓶中,置于冷暗处
B.用瓷坩埚来加热烧碱或纯碱使其熔化
C.用蒸馏水鉴别溴蒸气和二氧化氮气体
D.用盐酸为抛光液,抛光单晶硅
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的数值,下列说法正确的是
A.常温常压下,8gO2含有2NA个电子
B.10L 0.1mol·L-1的氨水中有NA个NH4+
C.标准状况下,22.4L盐酸含有NA个HCl分子
D.1molNa与足量氧气反应生成Na2O和Na2O2的混合物,失去NA个电子
难度: 中等查看答案及解析
-
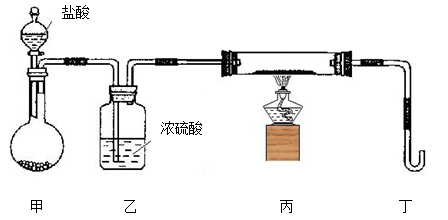
实验是研究化学的基础。关于下列各装置图的叙述中,正确的是
A.装置①常用于实验室制取氨
B.装置②中X若为苯,可用于吸收氨气,并防止倒吸
C.装置③可用于制备氢氧化亚铁并观察其颜色
D.装置④可验证HCl气体在水中的溶解性
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.铜与浓硫酸反应放出SO2:Cu + 4H++SO42-=Cu2++SO2↑+2H2O
B.加热NH4Cl和氢氧化钠固体混合物:NH4+ + OH- = NH3↑ + H2O
C.稀硝酸与过量的铁屑反应: Fe + 4H+ + NO3- = Fe3+ + NO↑ + 2 H2O
D.氯气通入FeCl2溶液中:Cl2 + 2Fe2+ =2Fe3+ + 2Cl-
难度: 中等查看答案及解析
-
在一定量的偏铝酸钠溶液中,加入下列哪一种溶液可使获得的沉淀量最大
A.硫酸铝 B.盐酸 C.二氧化碳 D.硫酸
难度: 中等查看答案及解析
-
下列说法正确的是
A.氨的催化氧化是一种特殊的固氮方式
B.工业冶炼铝:电解熔融AlCl3固体
C.将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中不一定有铁
D.用加热分解的方法可将NH4Cl固体和Ca(OH)2固体的混合物分离
难度: 中等查看答案及解析
-
下列有关Fe2(SO4)3溶液的叙述正确的是
A.该溶液中K+、Fe2+、SCN-、Br-可以大量存在
B.和KI溶液反应的离子方程式: Fe3++2I-=Fe2++I2
C.和Ba(OH)2溶液反应离子方程式:Fe3++ SO42-+Ba2++3OH-=Fe(OH)3↓+BaSO4↓
D.1 L0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2g Fe
难度: 困难查看答案及解析
-
有一块镁铝合金,其中镁与铝的质量比是8:9,加入足量稀硫酸使其完全溶解后,再加入NaOH 溶液,生成的沉淀的质量随NaOH 溶液体积变化的曲线如下图,其中正确的是

难度: 中等查看答案及解析
-
在离子浓度都为0.1 mol/L下列溶液中,加入(或通入)某物质后,发生反应先后顺序正确是
A.在含Fe3+、 Cu2+、 H+的溶液中加入锌粉:Cu 2+、 Fe3+、H+
B.在含I-、SO32-、Br-的溶液中不断通入氯气:I-、Br-、SO32-
C.在含AlO2-、SO32-、OH-的溶液中逐滴加入硫酸氢钠溶液:OH-、AlO2-、SO32-
D.在含Fe 3+、 H+、NH4+ 的溶液中逐渐加入烧碱溶液:Fe3+、NH4+、H+
难度: 困难查看答案及解析
-
中国-094核潜艇上的核反应堆内使用了液体钠铝合金(单质钠和单质铝熔合而成,可看作二者的混合物)做载热介质,有关说法不正确的是
A.铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出
B.铝钠合金若投入一定的水中可得无色溶液,则n(Al)≤n(Na)
C.m g 钠铝合金投入足量水中,若所得溶液只含一种溶质,则其中含有钠的质量为0.46m g
D.若mg不同组成的铝钠合金投入足量盐酸中,若放出的H2越多,则钠的质量分数越大
难度: 中等查看答案及解析
-
X、Y、Z、W有如图所示的转化关系,则X、Y可能是
①C 、CO ②S、SO2
③AlCl3、Al(OH)3 ④Cl2、FeCl3
A.仅有①③ B.①②③ C.仅有②④ D.①②③④
难度: 中等查看答案及解析
-
下列实验不合理的是:
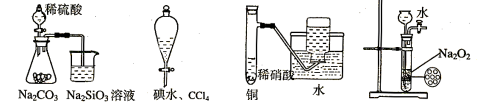
A.证明非金属性强弱 S>C>Si B.四氯化碳萃取碘水中的碘
C.制备并收集少量NO气体 D.制备少量氧气
难度: 中等查看答案及解析
-
固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想,其中不成立的是
A.Mg(NO2)2、NO2、O2 B.MgO、NO2、O2
C.Mg3N2、O2 D.MgO、NO2、N2
难度: 中等查看答案及解析
-
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
编号
叙述I
叙述II
A
SiO2的熔点很高
石英玻璃制作光学透镜
B
SO2具有漂白性
SO2能使高锰酸钾酸性溶液褪色
C
N2常压、-196℃条件下易液化
液氮应用于冷冻、麻醉
D
硬铝是合金
其熔点比金属铝的熔点高
难度: 中等查看答案及解析
-
将 CaCl2 和 CaBr2 的混合物 13.400 g溶于水配成 500.00 mL 溶液,再通入过量的 Cl2,完全反应后将溶液蒸干,得到干燥固体 11.175 g。则原配溶液中,c(Ca2+)∶c(Cl-)∶c(Br-)为
A.3∶2∶1 B.1∶2∶3 C.1∶3∶2 D.2∶3∶1
难度: 中等查看答案及解析
-
总压强为 3.0×107 Pa 时,N2、H2 混合气体(体积之比为 1∶3)通入合成塔中,反应达平衡时,压强降为 2.5×107 Pa,则平衡时混合气体中 NH3 的体积分数为
A.35% B.30% C.25% D.20%
难度: 中等查看答案及解析
-
将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是
A.加入合金的质量可能为9.6g
B.沉淀完全时消耗NaOH溶液体积为150mL
C.参加反应的硝酸的物质的量为0.4mol
D.溶解合金时产生NO气体体积2.24L
难度: 中等查看答案及解析
-
某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100 mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42-的物质的量浓度为6 mol·L-1,则此溶液最多溶解铁粉的质量为
A.5.6 g B.11.2 g C.22.4 g D.33.6 g
难度: 中等查看答案及解析