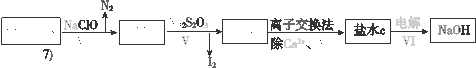
-
化学与生活、社会密切相关。下列说法正确的是
A.石油的分馏、煤的气化、海水提溴过程都包含化学变化
B.地沟油经处理后可作为汽车燃油,故地沟油成分是液态烃
C.淀粉、油脂、蛋白质都能水解,但水解产物不同
D.乙烯和苯都能使溴水褪色,且褪色的原因相同
难度: 中等查看答案及解析
-
用NA表示阿伏加徳罗常数的值,下列说法正确的是
A.常温常压下,2.24L 氯气与过量的氢氧化钠溶液完全反应转移的电子数为0.1NA
B.30g乙酸和甲醛的混合物中氧原子数为NA
C.25℃时,2L0.1mol/L的Na2CO3溶液中含有的CO32-总数为0.2 NA
D.某密闭容器中盛有0.2molSO2和0.1molO2,在一定条件下充分反应,生成SO3分子数为0.2 NA
难度: 中等查看答案及解析
-
下列关于离子反应及离子共存的说法中正确的是
A.能使甲基橙显红色的溶液中,Ba2+、Fe2+、Cl-、NO3-可以大量共存
B.钢铁发生吸氧腐蚀的正极反应:O2+4e-+4H+=2H2O
C.常温下,由水电离的c(H+)=10-12mol/L的溶液:K+、Na+、SiO32-、HCO3-可以大量共存
D.NaHCO3溶液中滴入少量Ca(OH)2溶液:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O
难度: 困难查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是
选项
实验操作
实验现象
结论
A
向某溶液中先滴加氯水,再滴加少量KSCN溶液。
溶液变成血红色
溶液中含有Fe2+
B
向10mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/LFeCl3溶液
白色沉淀转化为红褐色沉淀
证明在相同温度下的Ksp:
Mg(OH)2 >Fe(OH)3
C
常温下,向浓硫酸中投入铁片
铁片不溶解
常温下,铁不与浓硫酸反应
D
向盛有碘水的试管中加入CCl4后充分振荡静置
液体分层,上层基本无色,下层紫红色
碘在CCl4中的溶解度较大
难度: 中等查看答案及解析
-
已知
一紫罗兰酮的结构简式是
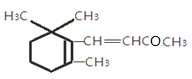 ,关于该有机物的说法正确的是
,关于该有机物的说法正确的是A.其分子式为C13H18O
B.能使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色
C.属于芳香族化合物
D.能发生加成反应、取代反应、水解反应
难度: 中等查看答案及解析
-
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3mol/L,则该溶液中溶质的pC=3。下列叙述正确的是
A.某温度下任何电解质的水溶液中,pC(H+) +pC(OH-)=14
B.0.01mol/L的CaCl2溶液中逐滴加入纯碱溶液,滴加过程中pC(Ca2+)逐渐减小
C.用0.01mol/L的盐酸滴定某浓度的NaOH溶液,滴定过程中pC(H+)逐渐增大
D.某温度下,难溶性离子化合物AB的Ksp=1.0×10-10, 其饱和溶液中pC(A+)+pC(B-)=10
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是
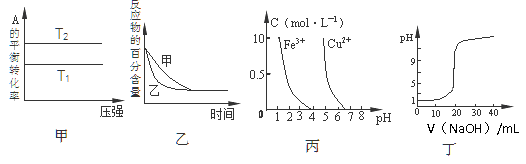
A.由图甲可以判断:对于反应aA(g)+ bB(g)
cC(g),若T1>T2, 则a +b=c且 △H<0
B.图乙表示压强对可逆反应2A(g)+2 B(g)
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.根据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH溶液,调节pH≈4
D.图丁表示用0.1000mol/LNaOH溶液滴定20.00mL0.1000mol/L醋酸溶液得到的滴定曲线
难度: 中等查看答案及解析