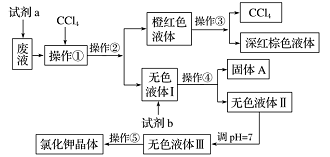
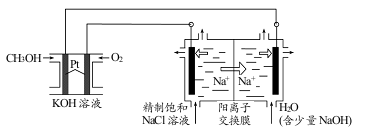
-
化学与人类生产、生活密切相关,下列有关说法正确的是
A.工业上用惰性电极电解熔融的MgO可制得Mg
B.为加快漂白精的漂白速率,使用时可滴加几滴醋酸
C.草木灰可与铵态氮肥混合施用
D.氢氧化铝、氢氧化钠、碳酸钠都是常见的胃酸中和剂
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法中正确的是
A.标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.1NA
B.电解饱和食盐水,当阴极产生2.24L H2时,转移的电子数为0.2NA
C.常温下,1.0L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1N
D.将100mL0.1mol·L -1 的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA
难度: 困难查看答案及解析
-
常温下,在下列指定条件的各溶液中,一定能大量共存的离子组是
A.中性溶液中:K+、Fe3+、ClO-、SO42-
B.pH<7的溶液中:Na+、Ba2+、Br-、Cl-
C.加入金属镁能产生H2的溶液中:Na+、Fe2+、SO42-、NO3-
D.c(H+)/c(OH-)=10-12的溶液中:K+、NH4+、HCO3-、NO3-
难度: 中等查看答案及解析
-
下列解释事实的化学方程式或离子方程式不正确的是
A.向AgCl悬浊液中加入KI溶液:AgCl(s)+I-(aq)=AgI(s)+Cl-(aq)
B.明矾净水:Al3++3H2O
Al(OH)3+3H+
C.90℃时,测得纯水中Kw=3.8×10-13:H2O(l)
H+(aq)+OH-(aq) △H<0
D.用热的纯碱溶液可以清洗油污:CO32-+H2O
HCO3-+OH-
难度: 中等查看答案及解析
-
已知K2Cr2O7溶液中存在如下平衡:Cr2O7 2-(橙色)+ H2O
2H++ 2CrO42- (黄色)。
①向2mL 0.1mol·L K2Cr2O7溶液中滴入3滴6mol/L NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色;
②向酸化K2Cr2O7溶液中滴入适量Na2SO3溶液,溶液由橙色变为绿色:
Cr2O72- + 8H++ 3SO32-=2Cr3+(绿色) + 3SO42- + 4H2O
下列分析正确的是
A.CrO42-和S2-在酸性溶液中可大量共存
B.实验②说明氧化性:Cr2O72->SO42-
C.稀释K2Cr2O7溶液时,溶液中各离子浓度均减小
D.实验①和②均能证明K2Cr2O7溶液中存在上述平衡
难度: 困难查看答案及解析
-
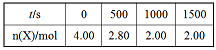
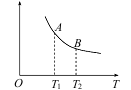
在2L恒容密闭容器中充入2 mol X和1mol Y发生反应:2X(g) +Y(g)
3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示。下列推断正确的是
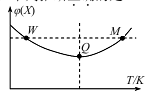
A.Q点时,Y的转化率最大
B.升高温度,平衡常数增大
C.W点X的正反应速率等于M点X的正反应速率
D.平衡时充入Z,达到新平衡时Z的体积分数增大
难度: 困难查看答案及解析
-
下列关系式中,正确的是
A.等浓度等体积的CH3COOH和CH3COONa溶液混合:c(CH3COO- )+c(OH -)=c(H+)+c(CH3COOH)
B.常温下,0.1 mol·L-1 HA溶液与0.1 mol/LNaOH溶液等体积完全反应时,溶液中一定存在:c(Na+)=c(A- )>c(OH )=c(H+)
C.常温下,0.1 mol·L-1 Na2S溶液中存在:c(OH- )=c(H+)+c(HS- )+c(H2S)
D.常温下,将0.1 mol·L-1 CH3COOH溶液加水稀释,当溶液的pH从3.0升到5.0时,溶液中c(CHCOO-)/c(CHCOOH)的值增大到原来的100倍
难度: 困难查看答案及解析