-
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。下列分析正确的是( )
A. 上述实验条件下,物质的氧化性:Cu2+>I2>SO2
B. 通入SO2时,SO2与I2反应,I2作还原剂
C. 通入SO2后溶液逐渐变成无色,体现了SO2的漂白性
D. 滴加KI溶液时,转移2 mol e-时生成1 mol白色沉淀
-
下列实验操作、现象和结论均正确的是
| 实验操作 | 现象 | 结论 |
| A | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者均能与盐酸反应 |
| B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3∙H2O能大量共存 |
| C | 将可调高度的铜丝伸入到稀HNO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 上层溶液显紫红色 | 氧化性:Fe3+>I2 |
A. A B. B C. C D. D
-
化学与生产、生活密切相关。下列叙述正确的是( )
A. 明矾水解时产生具有吸附性的胶体粒子,可杀菌消毒
B. 根据分散质粒子的直径大小,分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液与胶体之间
C. 碳素钢和光导纤维都属于新型的无机非金属材料
D. 葡萄糖注射液不能产生丁达尔效应,不属于胶体
-
下列说法正确的是 ( )
A. 因为SO2具有漂白性,所以它能使品红溶液、溴水、酸性KMnO4溶液、石蕊试液褪色
B. 能使品红溶液褪色的物质不一定是SO2
C. SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,且原理相同
D. 等物质的量的SO2和Cl2混合后通入装有湿润的有色布条的集气瓶中,漂白效果更好
-
下列说法不正确的是( )
A. 光催化还原水制氢比电解水制氢更节能环保、更经济
B. 氨氮废水(含NH4+及NH3)可用化学氧化法或电化学氧化法处理
C. 某种光学检测技术具有极高的灵敏度,可检测到单个细胞(V≈10-12L)内的数个目标分子,据此可推算该检测技术能测量细胞内浓度约为10-12~10-11mol·L-1的目标分子
D. 向汽油中添加甲醇后,该混合燃料的热值不变
-
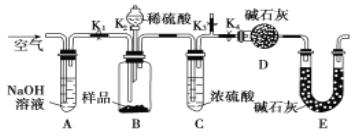
用质量分数为98%的浓硫酸(ρ=1.84 g·cm-3)配制240 mL 1.84 mol·L-1稀硫酸,下列操作正确的是( )
A. 将蒸馏水缓慢注入盛有一定量浓硫酸的烧杯中,并不断搅拌至冷却
B. 必需的定量仪器有100 mL量筒、250 mL容量瓶和托盘天平
C. 量取浓硫酸的体积为25.0 mL
D. 先在容量瓶中加入适量水,将量好的浓硫酸注入容量瓶,加水定容
-
下列离子方程式书写正确的是:
A.碳酸氢镁溶液中加入过量的NaOH溶液:Mg2++2HCO3-十4OH一=Mg(OH)2 ↓2H2O+2CO32—
B.NaHSO4溶液与Ba(OH)2溶液混合后显酸性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
C.少量C12通入水中:Cl2 +H2O 2H++C1O-十C1-
2H++C1O-十C1-
D.酸性高锰酸钾可使草酸溶液褪色:2MnO4-+5C2O42-+16H+= 2Mn2++ l0CO2 ↑+8H2O
-
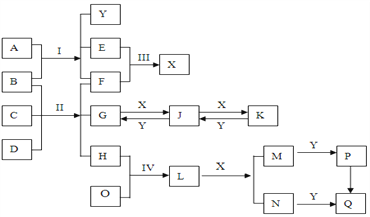
如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )
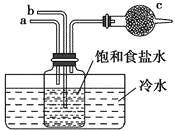
A. a通入CO2,然后b通入NH3,c中放碱石灰
B. b通入NH3,然后a通入CO2,c中放碱石灰
C. a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D. b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
-
下列图示实验正确的是
A. 除去粗盐溶液中的不溶物 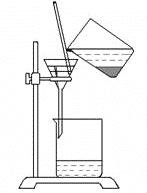
B. 碳酸氢钠受热分解
C. 除去CO气体中的CO2气体 
D. 乙酸乙酯的制备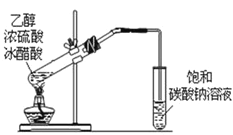
-
给定条件下,下列选项中所示的物质间转化均能一步实现的是
A. 粗硅 SiCl4
SiCl4 Si
Si
B. Mg(OH)2 MgCl2(aq)
MgCl2(aq) Mg
Mg
C. Fe2O3 FeCl3(aq)
FeCl3(aq) 无水FeCl3
无水FeCl3
D. AgNO3(aq) [Ag(NH3)2]OH(aq)
[Ag(NH3)2]OH(aq) Ag
Ag
-
海水开发利用的部分过程如图所示。下列说法错误的是
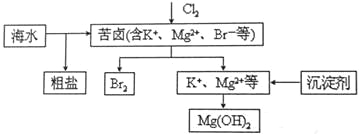
A. 向苦卤中通入Cl2是为了提取溴
B. 粗盐可采用除杂和重结晶等过程提纯
C. 工业生产中常选用NaOH作为沉淀剂
D. 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
-
今有甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1 mol·L-1。如果在甲瓶中加入少量的NaHCO3晶体(n mol),在乙瓶中加入少量的NaHSO3晶体(n mol),丙瓶不变。片刻后,甲、乙、丙三瓶溶液中HClO的物质的量浓度的大小关系是(溶液体积变化忽略不计)( )
A. 甲=乙>丙 B. 甲>丙>乙 C. 丙>甲=乙 D. 乙>丙>甲
-
氰(CN)2的结构简式为N≡C—C≡N,其化学性质与卤素(X2)很相似,化学上称之为拟卤素,其氧化性介于Br2和I2之间。下列有关反应的化学方程式不正确的是( )
A. (CN)2+H2=2HCN
B. MnO2+4HCN=Mn(CN)2+(CN)2↑+2H2O
C. 向KCN溶液中加入碘水:I2+2KCN=2KI+(CN)2
D. 在NaBr和KCN混合液中通入少量Cl2:Cl2+2KCN=2KCl+(CN)2
-
下列有关硫元素及其化合物的说法或描述正确的是( )
A. 硫黄矿制备硫酸经历两步:S→SO3→H2SO4
B. 酸雨与土壤中的金属氧化物反应后,硫元素以单质的形式进入土壤中
C. 在燃煤中加入石灰石可减少SO2排放,发生的反应为
2CaCO3+2SO2+O2=2CO2+2CaSO4
D. 土壤中的闪锌矿(ZnS)遇到硫酸铜溶液转化为铜蓝(CuS),说明CuS很稳定,不具有还原性
-
已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,下列有关说法正确的是
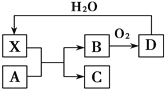
A. X使蔗糖变黑的现象主要体现了X的强氧化性
B. 若A为铁,则足量A与X在室温下即可完全反应
C. 若A为碳单质,则将C通入少量的澄清石灰水,一定可以观察到白色沉淀产生
D. 工业上,B转化为D的反应条件为高温、常压、使用催化剂
-
海水中主要含有Na+、K+、Mg2+、Ca2+、Cl-、Br-、SO42-、HCO3-、CO32-等离子,火力发电时排放的烟气可用海水脱硫,其工艺流程如下图所示,下列说法错误的是
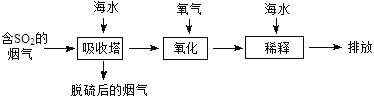
A.海水pH约为8的原因主要是天然海水含CO32-、HCO3-
B.吸收塔中发生的反应有SO2+H2O H2SO3
H2SO3
C.氧化主要是氧气将HSO3-、SO32-、H2SO3氧化为SO42-
D.经稀释“排放”出的废水中,SO42-浓度与海水相同
-
有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4 mol·L-1和2 mol·L-1,取10 mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的气体的体积为(设反应中HNO3被还原成NO)( )
A. 0.448 L B. 0.672 L C. 0.896 L D. 0.224 L
-
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)。下列分析或结果错误的是

A. 原混合酸中NO3-物质的量为0.1 mol
B. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
C. 第二份溶液中最终溶质为FeSO4
D. H2SO4浓度为2.5 mol·L-1
-
如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是( )
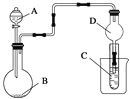
A. 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B. 若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
C. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解
D. 若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色
-
有关图示装置的叙述不正确的是( )

A. 装置①可用于吸收实验中多余的Cl2
B. 装置②可用于收集H2、NH3、Cl2、NO2等
C. 装置③中X为苯,可用于吸收氨气或氯化氢
D. 装置④可用于收集NH3,并吸收多余的NH3
-
表中a、b、c表示相应仪器中加入的试剂,可用如图所示装置制取、净化、收集的气体是 ( )
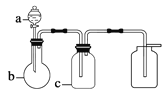
| 编号 | 气体 | a | b | c |
| A | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| B | SO2 | 70%浓H2SO4 | Na2SO3固体 | 98%浓H2SO4 |
| C | NO | 稀HNO3 | 铜屑 | H2O |
| D | NO2 | 浓HNO3 | 铜屑 | NaOH溶液 |
A. A B. B C. C D. D

5KCl+KClO3+3H2O,在密闭容器中向9 ℃的KOH溶液中通入少量Cl2,此时Cl2的氧化产物主要是________________;继续通入适量Cl2,将溶液加热,溶液中主要离子的浓度随温度的变化如图所示,图中甲、乙、丙依次表示的离子是_________。(不考虑Cl2的挥发)
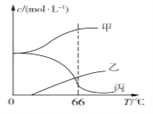
2Cr3++6Fe3++7H2O,ClO3−可被Fe2+还原为Cl−。)