-
KClO3晶体是一种常见的氧化剂,生产工艺如图所示:
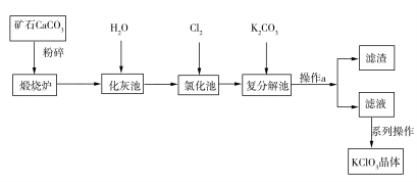
请回答下列问题:
(1)CaCO3煅烧前要粉碎的目的是____________________________。
(2)写出“氯化池”中生成Ca(ClO3)2的化学方程式:___________________________。该反应中,氧化剂与还原剂的物质的量之比为________。
(3)操作a中所需的玻璃仪器有漏斗、烧杯、__________。
(4)实验室制取KClO3可通过反应:3Cl2+6KOH 5KCl+KClO3+3H2O,在密闭容器中向9 ℃的KOH溶液中通入少量Cl2,此时Cl2的氧化产物主要是________________;继续通入适量Cl2,将溶液加热,溶液中主要离子的浓度随温度的变化如图所示,图中甲、乙、丙依次表示的离子是_________。(不考虑Cl2的挥发)
5KCl+KClO3+3H2O,在密闭容器中向9 ℃的KOH溶液中通入少量Cl2,此时Cl2的氧化产物主要是________________;继续通入适量Cl2,将溶液加热,溶液中主要离子的浓度随温度的变化如图所示,图中甲、乙、丙依次表示的离子是_________。(不考虑Cl2的挥发)

(5)甲同学为测定制取的KClO3样品中ClO3−的含量,称取样品a g,准确配制成1000 mL溶液,从上述溶液中取出10.00 mL于锥形瓶中,准确加入30.00 mL 1.00 mol·L−1 (NH4)2Fe(SO4)2溶液(过量)。再在锥形瓶中加入100 mL蒸馏水及某种氧化还原反应指示剂,用0.200 mol·L−1 K2Cr2O7标准溶液滴定至终点,消耗5.00 mL。样品中ClO3−的质量分数为______________。(已知:Cr2O72-+6Fe2++14H+ 2Cr3++6Fe3++7H2O,ClO3−可被Fe2+还原为Cl−。)
2Cr3++6Fe3++7H2O,ClO3−可被Fe2+还原为Cl−。)
-
KClO3晶体是一种常见的氧化剂,生产工艺如图所示:

请回答下列问题:
(1)CaCO3煅烧前要粉碎的目的是____________________________。
(2)写出“氯化池”中生成Ca(ClO3)2的化学方程式:___________________________。该反应中,氧化剂与还原剂的物质的量之比为________。
(3)操作a中所需的玻璃仪器有漏斗、烧杯、__________。
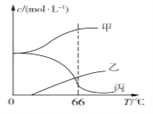
(4)实验室制取KClO3可通过反应:3Cl2+6KOH 5KCl+KClO3+3H2O,在密闭容器中向9 ℃的KOH溶液中通入少量Cl2,此时Cl2的氧化产物主要是________________;继续通入适量Cl2,将溶液加热,溶液中主要离子的浓度随温度的变化如图所示,图中甲、乙、丙依次表示的离子是_________。(不考虑Cl2的挥发)
5KCl+KClO3+3H2O,在密闭容器中向9 ℃的KOH溶液中通入少量Cl2,此时Cl2的氧化产物主要是________________;继续通入适量Cl2,将溶液加热,溶液中主要离子的浓度随温度的变化如图所示,图中甲、乙、丙依次表示的离子是_________。(不考虑Cl2的挥发)
(5)甲同学为测定制取的KClO3样品中ClO3−的含量,称取样品a g,准确配制成1000 mL溶液,从上述溶液中取出10.00 mL于锥形瓶中,准确加入30.00 mL 1.00 mol·L−1 (NH4)2Fe(SO4)2溶液(过量)。再在锥形瓶中加入100 mL蒸馏水及某种氧化还原反应指示剂,用0.200 mol·L−1 K2Cr2O7标准溶液滴定至终点,消耗5.00 mL。样品中ClO3−的质量分数为______________。(已知:Cr2O72-+6Fe2++14H+ 2Cr3++6Fe3++7H2O,ClO3−可被Fe2+还原为Cl−。)
2Cr3++6Fe3++7H2O,ClO3−可被Fe2+还原为Cl−。)
-
KClO3晶体是一种常见的氧化剂,生产工艺如图所示:
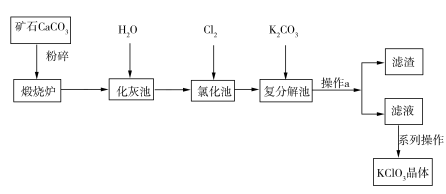
请回答下列问题:
(1)CaCO3煅烧前要粉碎的目的是____________________________。
(2)写出“氯化池”中生成Ca(ClO3)2的化学方程式:___________________________。该反应中,氧化剂与还原剂的物质的量之比为________。
(3)操作a中所需的玻璃仪器有漏斗、烧杯、__________。
(4)“复分解池”反应中,发生反应的离子方程式为_________________。
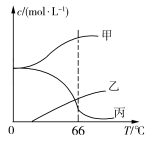
(5)实验室制取KClO3可通过反应:3Cl2+6KOH 5KCl+KClO3+3H2O,在密闭容器中向9 ℃的KOH溶液中通入少量Cl2,此时Cl2的氧化产物主要是________________;继续通入适量Cl2,将溶液加热,溶液中主要离子的浓度随温度的变化如图所示,图中甲、乙、丙依次表示的离子是____________________________。(不考虑Cl2的挥发)
5KCl+KClO3+3H2O,在密闭容器中向9 ℃的KOH溶液中通入少量Cl2,此时Cl2的氧化产物主要是________________;继续通入适量Cl2,将溶液加热,溶液中主要离子的浓度随温度的变化如图所示,图中甲、乙、丙依次表示的离子是____________________________。(不考虑Cl2的挥发)
(6)甲同学为测定制取的KClO3样品中 的含量,称取样品a g,准确配制成1000 mL溶液,从上述溶液中取出10.00 mL于锥形瓶中,准确加入30.00 mL 1.00 mol·L−1 (NH4)2Fe(SO4)2溶液(过量)。再在锥形瓶中加入100 mL蒸馏水及某种氧化还原反应指示剂,用0.200 mol·L−1 K2Cr2O7标准溶液滴定至终点,消耗5.00 mL。样品中
的含量,称取样品a g,准确配制成1000 mL溶液,从上述溶液中取出10.00 mL于锥形瓶中,准确加入30.00 mL 1.00 mol·L−1 (NH4)2Fe(SO4)2溶液(过量)。再在锥形瓶中加入100 mL蒸馏水及某种氧化还原反应指示剂,用0.200 mol·L−1 K2Cr2O7标准溶液滴定至终点,消耗5.00 mL。样品中 的质量分数为______________。(已知:
的质量分数为______________。(已知: +6Fe2++14H+
+6Fe2++14H+ 2Cr3++6Fe3++7H2O,
2Cr3++6Fe3++7H2O, 可被Fe2+还原为Cl−。)
可被Fe2+还原为Cl−。)
-
某厂从废催化剂(主要含Pt、Al2O3、石墨等)中回收海绵铂和硫酸铝晶体。工艺流程如下:

请回答下列问题:
(1)第①步通入空气煅烧的目的是_____________________________。
(2)第②步用热酸研磨浸出而不是直接浸出的原因是_____________________________。
(3)写出第③步反应的离子方程式:_____________________________。
(4)此流程中的四个操作中有三个是相同的,其名称是__________,在实验室进行此操作使用的主要玻璃仪器有___________________。溶液Y中可以循环使用的物质是____________(填化学式)。
(5)用返滴定法测定硫酸铝晶体中铝的含量:称取硫酸铝晶体0.5400 g,用2.0 mL 3.0 mol·L−1的硫酸溶解后制成250 mL溶液,取25.00 mL于锥形瓶中,加入0.02 mol·L−1的EDTA标准液20.00 mL和缓冲溶液,加热5 min,冷却至室温,加2滴二甲酚橙指示剂,用0.02 mol·L−1的标准ZnSO4溶液滴定至终点消耗5.00 mL。则该晶体中铝的质量分数为___________。(已知Al3+、Zn2+与EDTA反应的方程式如下:Al3++H2Y2− AlY−+2H+,H2Y2−+Zn2+
AlY−+2H+,H2Y2−+Zn2+ ZnY2−+2H+)
ZnY2−+2H+)
-
(12分)【化学——化学与技术】
工业上以黄铁矿为原料,采用接触法生产硫酸。请回答下列问题:
(1)煅烧黄铁矿的设备名称是__________,进料前必须将黄铁矿粉碎,目的是________。所得炉渣的用途有__________________________(填一种用途)。
(2)进入接触室前的气体必须经过净化处理,目的是防止________________________________。
(3)生产过程中,吸收三氧化硫常用的物质是_____________________________。
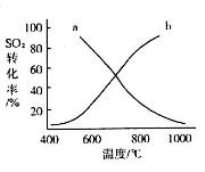
(4)温度变化与二氧化硫转化率的变化关系可用下图中的曲线______(填“a”或“b”)表示。
(5)工业上常用熟石灰和硫酸处理、回收尾气中的有害气体。反应的化学方程式为:
________________________________、_________________________________。
-
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeC13·6H2O)的工艺流程如下:
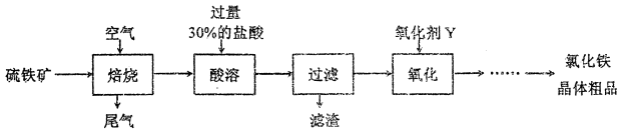
请按要求回答下列问题:
(1)需将硫铁矿粉碎再焙烧的目的是________________。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是____________、________________。
(3)氧化剂Y可以是Cl2或_______,其各自的优点是_____________、_______________。
(4)尾气主要含N2、O2、气体Z和少量的CO2、H2O。取标准状况下的VL尾气测定其中气体Z含量的方案如下:
【方案一】:将尾气缓慢通过如下装置A中:
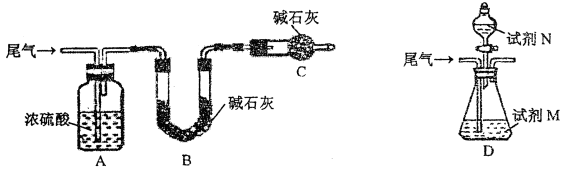
①C仪器的名称是_______________,该装置的作用是______________。
②实验时先通入尾气,再通入一定量氮气,通过B装置的增重来测量气体Z的体积分数,请写出该方案合理与否的理由___________________。
【方案二】:将尾气缓慢通过如上装置D中,充分与足量试剂M反应后,再滴入过量试剂N,经过滤、洗涤、干燥、称量,得沉淀质量为mg。
③若试剂M、N分别是溴水、BaCl2溶液,写出方案所涉及反应的离子方程式:_________________、______________。
写出气体Z的体积百分含量的表达式是(用含m、V的代数式表示)_____________________。
④若试剂M、N分别是NaHCO3溶液、BaCl2溶液,所得沉淀的化学式为________。
⑤若试剂M是Ba(NO3)2溶液,不再滴加试剂N,观察到D中生成的无色气体在瓶口处变为红棕色。写出溶液中反应的离子方程式:________________。
-
以黄铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
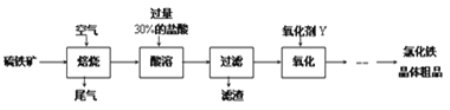
请按要求回答下列问题:
(1)需将硫铁矿粉碎再焙烧的目的是______________________________________.
(2)酸溶及后续过程中均需保持盐酸过量,其目的是_____________、__________.
(3)尾气主要含N2、O2、SO2和少量的CO2、H2O(g).测定尾气中SO2含量的方案如下:
(方案甲)将标准状况下的2.24 L尾气缓慢通过如下装置A中:
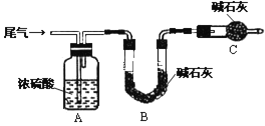
①C仪器的名称是_______________,装置C的作用是_________________________.
②实验时先通入尾气,再通入一定量氮气,通过B装置的增重来测量SO2的体积分数,请写出该方案合理与否的理由__________________________________________.
(方案乙)将标准状况下的2.24 L尾气缓慢通过如下装置D中,充分与足量试剂M反应后,再滴入过量试剂N,经过滤、洗涤、干燥、用电子天平称得沉淀质量为0.233g.
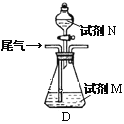
③若试剂M、N分别是碘水、BaCl2溶液,写出D中总反应的离子方程式: __________________.尾气中SO2的体积分数为__________________.
④若试剂M是Ba(NO3)2溶液,不再滴加试剂N,观察到D中生成的无色气体在瓶口处变为红棕色.写出SO2和Ba(NO3)2溶液反应的离子方程式:___________________________.
-
以黄铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
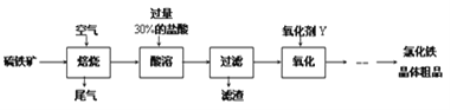
请按要求回答下列问题:
(1)需将硫铁矿粉碎再焙烧的目的是______________________________________.
(2)酸溶及后续过程中均需保持盐酸过量,其目的是_____________、__________.
(3)尾气主要含N2、O2、SO2和少量的CO2、H2O(g).测定尾气中SO2含量的方案如下:
(方案甲)将标准状况下的2.24 L尾气缓慢通过如下装置A中:
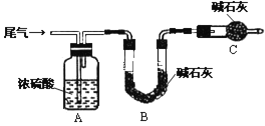
①C仪器的名称是_______________,装置C的作用是_________________________.
②实验时先通入尾气,再通入一定量氮气,通过B装置的增重来测量SO2的体积分数,请写出该方案合理与否的理由__________________________________________.
(方案乙)将标准状况下的2.24 L尾气缓慢通过如下装置D中,充分与足量试剂M反应后,再滴入过量试剂N,经过滤、洗涤、干燥、用电子天平称得沉淀质量为0.233g.
③若试剂M、N分别是碘水、BaCl2溶液,写出D中总反应的离子方程式: __________________.尾气中SO2的体积分数为__________________.
④若试剂M是Ba(NO3)2溶液,不再滴加试剂N,观察到D中生成的无色气体在瓶口处变为红棕色.写出SO2和Ba(NO3)2溶液反应的离子方程式:___________________________.
-
以黄铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:

请按要求回答下列问题:
(1)需将硫铁矿粉碎再焙烧的目的是______________________________________.
(2)酸溶及后续过程中均需保持盐酸过量,其目的是_____________、__________.
(3)尾气主要含N2、O2、SO2和少量的CO2、H2O(g).测定尾气中SO2含量的方案如下:
(方案甲)将标准状况下的2.24 L尾气缓慢通过如下装置A中:

①C仪器的名称是_______________,装置C的作用是_________________________.
②实验时先通入尾气,再通入一定量氮气,通过B装置的增重来测量SO2的体积分数,请写出该方案合理与否的理由__________________________________________.
(方案乙)将标准状况下的2.24 L尾气缓慢通过如下装置D中,充分与足量试剂M反应后,再滴入过量试剂N,经过滤、洗涤、干燥、用电子天平称得沉淀质量为0.233g.

③若试剂M、N分别是碘水、BaCl2溶液,写出D中总反应的离子方程式: __________________.尾气中SO2的体积分数为__________________.
④若试剂M是Ba(NO3)2溶液,不再滴加试剂N,观察到D中生成的无色气体在瓶口处变为红棕色.写出SO2和Ba(NO3)2溶液反应的离子方程式:___________________________.
-
铬铁矿主要含有亚铬酸亚铁 ,还含有少量
,还含有少量 和
和 。由铬铁矿制备
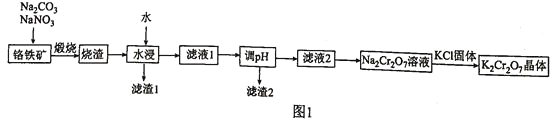
。由铬铁矿制备 的流程如图1所示:
的流程如图1所示:
已知:常温下, ,
, 。
。
回答下列问题:
(1)铬铁矿与 、
、 混合煅烧之前应先将其粉碎,目的是_______________。
混合煅烧之前应先将其粉碎,目的是_______________。
(2) “煅烧”过程中主要反应的化学方程式为_______ _______
_______ _______
_______ _______
_______ _______
_______ _______
_______ _______
_______ 。
。
(3)已知: 和
和 与
与 高温煅烧可生成
高温煅烧可生成 和
和 。“滤渣1”的主要成分为_____________________
。“滤渣1”的主要成分为_____________________ 填化学式
填化学式 ,其一种用途为_____________________
,其一种用途为_____________________
(4)“调pH”的过程即是用酸酸化使pH约为5,其目的是_____________________,“滤渣2”的主要成分为_____________________ 填化学式
填化学式 ,同时
,同时 转化为
转化为 ,此转化过程的离子方程式为____________________________。
,此转化过程的离子方程式为____________________________。
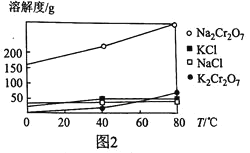
(5)  、KCl、
、KCl、 、NaCl的溶解度曲线如图2所示,结合图象解释向
、NaCl的溶解度曲线如图2所示,结合图象解释向 溶液中加入KCl固体经一系列操作后得到
溶液中加入KCl固体经一系列操作后得到 的理由:_____________________________。
的理由:_____________________________。
(6)该流程产生的含铬废水不能随意排放,可通过电解法处理 装置如图3所示
装置如图3所示 ,电解时,在阴极区可生成
,电解时,在阴极区可生成 和
和 沉淀,电解后溶液中
沉淀,电解后溶液中 ,则溶液中
,则溶液中 ____________
____________ 。
。

5KCl+KClO3+3H2O,在密闭容器中向9 ℃的KOH溶液中通入少量Cl2,此时Cl2的氧化产物主要是________________;继续通入适量Cl2,将溶液加热,溶液中主要离子的浓度随温度的变化如图所示,图中甲、乙、丙依次表示的离子是_________。(不考虑Cl2的挥发)

2Cr3++6Fe3++7H2O,ClO3−可被Fe2+还原为Cl−。)


















