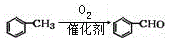-
下列说法错误的是
A. 长期饮用纯净水可能引起微量元素缺乏症
B. 合理使用食品添加剂可以保持或增强食品的营养
C. 食品还原性漂白剂,是以二氧化硫为基础的一系列衍生物
D. 锌能促进生长发育,应大剂量补锌
难度: 简单查看答案及解析
-
用NA 表示阿伏加德罗常数的值。下列叙述正确的是
A. 标准状况下,22.4LNO与11.2LO2充分反应后得到的气体分子数为NA
B. 3.6g重水中含有的中子数为2 NA
C. 常温下,1L1mol·L-1的CH3COOH溶液中,所含溶质分子数小于NA
D. 一定条件下,6.4g铜与过量的硫反应,转移电子数目为0.2 NA
难度: 简单查看答案及解析
-
X、Y、Z、W 是原子序数依次增大的短周期主族元素。X 和Z 同主族,可形成两种常见的分子,Y 和Z最外层电子数之和与W 的最外层电子数相同。下列说法错误的是
A. 非金属性X>Z
B. X、Y、W 三种元素组成化合物的水溶液均显碱性
C. 原子半径: Y>Z>W>X
D. 在X、Y 形成的两种常见的离子化合物中阴阳离子的个数比分别均为1:2
难度: 中等查看答案及解析
-
下列对于有机物
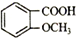 的叙述正确的是
的叙述正确的是A. 在一定条件下1mol 该物质最多与4molH2发生加成反应
B. 该物质不能与碳酸氢钠反应放出二氧化碳
C. lmol 该物质与足量的金属钠反应生成2molH2
D. 该物质含羟基与苯环直接相连的结构且能水解的同分异构体有19 种
难度: 简单查看答案及解析
-
锂-碘电池应用于心脏起搏器,使用寿命超过10 年,负极是锂,正极是聚2-乙烯吡(P2VP) 和I2 复合物,工作原理2Li+ P2VP·nI2=2LiI+ P2VP·(n-1)I2,下列叙述错误的是
A. 该电池是电解质为非水体系的二次电池
B. 工作时Li+向正极移动
C. 正极反应式为P2VP·nI2+2Li++2e-=2LiI+ P2VP·(n-1)I2
D. 该电池具有全时间工作、体积小、质量小、寿命长等优点
难度: 中等查看答案及解析
-
下图是某水溶液常温下pH 从0 到14 的范围内H2CO3、HCO3-、CO32- 三种成分平衡时组成分数,下列叙述正确的是
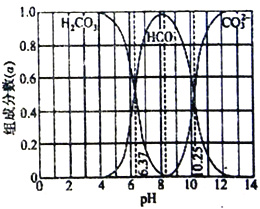
A. 此图是1.0mol/L碳酸钠溶液滴定1.0mol/L 盐酸的滴定曲线
B. 向pH=10.25 的溶液中通HCl 气体使pH=7,此时c(H2CO3)>c(Cl-)= c(HCO3-)>c(CO32- )
C. 人体血液的pH 约为7.4,则CO2在血液中多以HCO3-形式存在
D. 该温度下,碳酸氢根的水解平衡常数Kh= 10-3.75
难度: 困难查看答案及解析
-
下列根据实验操作所得出的现象和结论均正确的是
实验操作
实验现象
结论
A
向某溶液中先滴加氯水,再滴加少量KSCN 溶液。
溶液变成血红色
溶液中含有Fe2+
B
将变黑的银器放入装满食盐水的铝盆中,二者直接接触。
银器恢复往日光泽
2Al+3Ag2S+6H2O=6Ag+2Al(OH)3+H2S↑
C
向铬酸盐溶液中加入硫酸
溶液由橙色变为黄色
铬酸根转变为重铬酸根
D
将石蜡油气化后,使气体流经碎瓷片,将生成的气体通入酸性高锰酸钾溶液
溶液紫红色褪去
碎瓷片的主要作用是使石蜡油受热均匀
A. A B. B C. C D. D
难度: 中等查看答案及解析
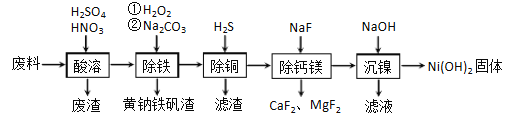
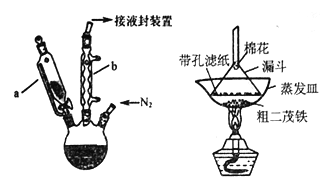
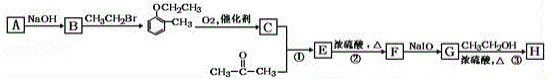
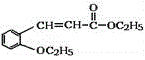 )是合成高分子化合物M的单体,H可以通过有机物A(分子式为C7H8O)和丙酮为原料来进行合成,其合成路线如下:
)是合成高分子化合物M的单体,H可以通过有机物A(分子式为C7H8O)和丙酮为原料来进行合成,其合成路线如下: