-
将V1mL1.0mol·L-1HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是

A.做该实验时环境温度为22℃ B.该实验表明热能可转化为化学能
C.NaOH溶液的浓度约为1.5mol·L-1 D.该实验表明有水生成的反应都是放热反应
难度: 极难查看答案及解析
-
下列有关反应热的叙述中正确的是
①已知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1,则氢气的燃烧热为△H=-241.8kJ·mol-1
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
③X(g)+Y(g)
Z(g)+W(s) △H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大
④已知:
共价键
C—C
C=C
C—H
H—H
键能/(kJ·mol-1)
348
610
413
436
上表数据可以计算出
 的焓变
的焓变⑤根据盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1molCO2固体时,放出的热量相等
⑥25℃,101kPa,1mol碳完全燃烧生成CO2所放出的热量为碳的燃烧热
A.①②③④ B.③④⑤ C.④⑤ D.⑥
难度: 简单查看答案及解析
-
把温度为20℃,浓度为1.0mol·L-1的H2SO4和2.2mol·L-1的碱溶液各50ml混合(溶液密度均为1g·ml-1,比热容为4.184kJ·K-1·kg-1),轻轻搅动。测得酸碱混合液的温度变化数据如下:
反应物
起始温度t1℃
终止温度t2℃
H2SO4+NaOH
20
33.6
H2SO4+NH3·H2O
20
32.6
则反应NH3·H2O=NH4++OH-的焓变约为(单位:kJ·mol-1)
A.2.1 B.4.2 C.52.7 D.缺少数据无法计算
难度: 简单查看答案及解析
-
为探究NaHCO3、Na2CO3与1mol·L-1盐酸反应(设两反应分别是反应I、反应II)过程中的热效应,进行实验并测得如下数据。下列有关说法正确的是
序号
35ml试剂
固体
混合前温度/℃
混合后温度/℃
①
水
2.5gNaHCO3
20.0
18.5
②
水
3.2gNa2CO3
20.0
24.3
③
盐酸
2.5gNaHCO3
20.0
16.2
④
盐酸
3.2gNa2CO3
20.0
25.1
由此得出的结论正确的是
A.仅通过实验③即可判断反应I是吸热反应
B.仅通过实验④即可判断反应II是放热反应
C.通过实验可判断出反应I、II分别是吸热反应、放热反应
D.通过实验可判断出反应I、II分别是放热反应、吸热反应
难度: 简单查看答案及解析
-
在298K、1.01×105Pa下,将22gCO2通入750mL 1mol/LNaOH溶液中充分反应,测得放出xkJ的热量。已知在该条件下,1 mol CO2通入1 L 2 mol/L NaOH溶液中充分反应放出y kJ的热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式是
A.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(2y-x)kJ/mol
B.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(2x-y)kJ/mol
C.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(4x-y)kJ/mol
D.2CO2(g)+2NaOH(l)=2NaHCO3(l) ΔH=-(8x-2y)kJ/mol
难度: 简单查看答案及解析
-
已知下列两个气态物质之间的反应:C2H2(g)+H2(g)
C2H4(g) ①
2CH4(g)
C2H4(g)+2H2(g) ②
已知在降低温度时①式平衡向右移动,②式平衡向左移动,则下列三个反应:(Q1、Q2、Q3均为正值)
C(s)+2H2(g)=CH4(g) ΔH=-Q1 I
2C(s)+H2(g)=C2H2(g) ΔH=-Q2 II
2C(s)+2H2(g)=C2H4(g) ΔH=-Q3 III
Q值大小比较正确的是
A.Q1>Q3>Q2 B.Q1>Q2>Q3 C.Q2>Q1>Q3 D.Q3>Q1>Q2
难度: 简单查看答案及解析
-
用H2O2和H2SO4的混合溶液可溶出废旧印刷电路板上的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) △H=+64.39kJ·mol-1
2H2O2(l)=2H2O(l)+O2(g) △H=-196.46kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) △H=-285.84kJ·mol-1
在H2SO4溶液中,Cu与H2O2反应生成Cu2+(aq)和H2O(l)的反应热△H等于
A.-417.91kJ·mol-1 B.-319.68kJ·mol-1 C.+546.69kJ·mol-1 D.-448.46kJ·mol-1
难度: 简单查看答案及解析
-
一定条件下A、B、C有如图所示的转化关系,且△H=△H1+△H2。符合上述转化关系的A、C可能是
①Fe、FeCl3 ②C、CO2 ③AlCl3、NaAlO2 ④NaOH、NaHCO3 ⑤S、SO3 ⑥Na2CO3、CO2
A.只有②③④⑥ B.除①外 C.除⑤外 D.全部
难度: 中等查看答案及解析
-
将Y1L的H2和Y2L的N2在一定条件下发生反应,达到平衡后,混合气体总体积为Y3L(气体体积均在相同条件下测定),则生成NH3的体积是
A.(Y1+Y2-Y3)L B.(Y1+Y2+Y3)L C.(Y1+ Y2-2Y3)L D.[Y3-(Y1+Y2)]L
难度: 简单查看答案及解析
-
某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)
2C(g)达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中各物质的物质的量浓度、反应速率分别随时间的变化如下图所示:下列说法中正确的是
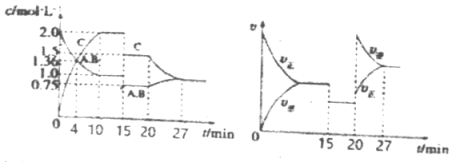
A.4min时反应第一次达到平衡
B.15min时降低压强,20min时升高温度
C.反应方程式中的x=1,正反应为吸热反应
D.15~20min该反应使用了催化剂
难度: 困难查看答案及解析
-
把3molP和2.5molQ置于密闭容器中,发生如下反应:3P(g)+Q(g)
xM(g)+2N(g),5min后达到平衡生成1molN,经测定M的平均速率是0.1mol/(L·min),下列叙述不正确的是
A.P的平均反应速率为0.15mol/(L·min)
B.Q的平衡浓度为1mol/L
C.Q的转化率为25%
D.x等于2
难度: 中等查看答案及解析
-
可以证明可逆反应N2+3H2
2NH3已达到平衡状态的是
①一个N≡N键断裂的同时,有3个H—H键断裂;
②一个N≡N键断裂的同时,有2个N—H键断裂;
③N2、H2、NH3浓度比为1:3:2
④保持其它条件不变时,体系压强不再改变;
⑤NH3、N2、H2的体积分数都不再改变
⑥恒温恒容时,混合气体的密度保持不变;
⑦正反应速率v(H2)=0.6mol/(L·min),逆反应速率v(NH3)=0.4mol/(L·min)
A.②⑤⑥ B.①④⑤ C.④⑤⑦ D.③⑥⑦
难度: 中等查看答案及解析
-
在一密闭容器中有如下反应:aX(g)+bY(g)
nW(g) △H,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
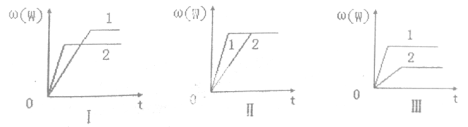
其中,ω(W)表示W在反应混合物中的体积分数,t表示反应时间。当其它条件不变时,下列分析正确的是
A.图I可能是不同压强对反应的影响,且p2>p1,a+b>n
B.图II可能是不同压强对反应的影响,且p1>p2,n<a+b
C.图II可能是在同温同压下催化剂对反应的影响,且1使用的催化剂效果好
D.图III可能是不同温度对反应的影响,且T1>T2,△H<0
难度: 困难查看答案及解析
-
为研究硫酸铜的量对锌与稀硫酸反应氢气生成速率的影响,该同学设计了如下一系列实验。表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需的时间。下列说法正确的是
实验 混合溶液
A
B
C
D
E
F
4mol/LH2SO4溶液
30
V1
V2
V3
V4
V5
饱和CuSO4溶液/mL
0
0.5
2.5
5
V6
20
H2O/mL
V7
V8
V9
V10
10
0
A. V1=30,V6=10
B.反应一段时间后,实验A,E中的金属呈暗红色
C.加入MgSO4与Ag2SO4可以起与硫酸铜相同的加速作用
D.硫酸铜的量越多,产生氢气的速率肯定越快
难度: 简单查看答案及解析
-
合成氨反应:N2(g)+3H2(g)
2NH3(g) △H=-92.4kJ·mol-1,在反应过程中,正反应速率的变化如图。下列说法正确的是
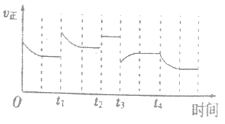
A.t1时升高了温度 B.t2时使用了催化剂
C.t3时增大了压强 D.t4时降低了温度
难度: 中等查看答案及解析
-
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol/LNaHSO3溶液(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断不正确的是
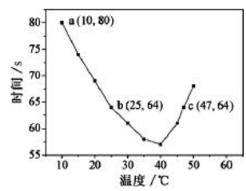
A.40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反
B.图中b、c两点对应的NaHSO3反应速率相等
C.图中a点对应的NaHSO3反应速率为5.0×10-5mol·L-1·s-1
D.温度高于40℃时,淀粉不宜用作该实验的指示剂
难度: 简单查看答案及解析