-
I.已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H=-1275.6kJ·mol-1
②H2O(l)=H2O(g) △H=+44.0kJ·mol-1
写出表示甲醇燃烧热的热化学方程式 。
II.甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g)+H2O(g) CO2(g)+3H2(g) △H>0
CO2(g)+3H2(g) △H>0
(1)一定条件下,向体积为2L的恒容密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得混合气体的压强是反映前的1.2倍,则用甲醇表示该反应的速率为 。
(2)判断(1)中可逆反应达到平衡状态的依据是(填序号) 。
① v正(CH3OH)=3v逆(H2)
混合气体的密度不变
混合气体的平均相对分子质量不变
④CH3OH、H2O、CO2、H2的浓度都不再发生变化
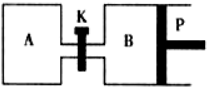
(3)右图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1molCH3OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g)和2.4molH2O(g),两容器分别发生上述反应。已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.5aL,容器B中CH3OH转化率为 ;维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为 L(连通管中气体体积忽略不计,且不考虑温度的影响)。
-
(14分)(1)已知常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H=-1275.6kJ/mol
②H2O(l)=H2O(g) △H=+44.0kJ/mol
写出甲醇燃烧的热化学方程式_____________________。
(2)甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。工业上用如下方法好处甲醇:
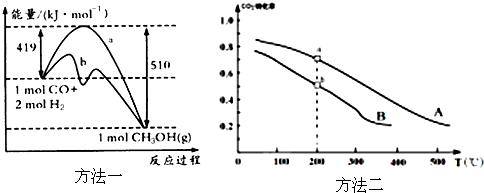
①方法一:该反应的△S_____0(填“>”或“<”)。图中曲线a到曲线b的措施是_________,恒温恒容时,下列说法能说明反应到达平衡状态的是________。
A.体系的平均摩尔质量不再改变 B.V(CO)=V(CH3OH)
C.H2的转化率达到了最大限度 D.△H不再改变
②方法二:将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应,如图两条曲线分别表示压强为0.1MPa和5.0MPa下CO2转化率随温度的变化关系,其中a点的平衡常数表达式为:___________;a,b两点化学反应速率别用Va、Vb表示,则Va_____Vb(填“大于”、“小于”或“等于”)。已知原子利用率=期望产物的总质量与生成物的总质量之比,则方法二的原子利用率与方法一的原子利用率之比为___。
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。写出除去甲醇的离子方程式_________。
-
(一)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g) △H=_1275.6kJ•mol-1
②H2O(l)═H2O(g) △H=+44.0kJ•mol-1
写出表示甲醇燃烧热的热化学方程式:______________________________。
(二)利用如图装置测定中和热的实验步骤如下:
①量取50mL0.25mol/LH2SO4溶液倒入小烧杯中,测量温度;
②量取50mL0.55mol/LNaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。
请回答:(1)如下图所示,仪器A的名称是_______________;
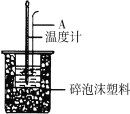
(2)设溶液的密度均为1g·cm-3,中和后溶液的比热容c=4.18J·(g·℃)-1,请根据实验数据写出该中和热的热化学方程式_______________________
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ |
| H2SO4 | NaOH | 平均值 |
| 1 | 25.0 | 25.2 | | 28.5 | |
| 2 | 24.9 | 25.1 | | 28.3 |
| 3 | 25.5 | 26.5 | | 31.8 |
| 4 | 25.6 | 25.4 | | 29.0 |
(3)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是_________ (填字母)
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定H2SO4溶液起始温度后直接测定NaOH溶液的温度
(4)已知:CH3COOH(aq)与NaOH(aq)反应的ΔH=-12.1kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-55.6kJ·mol-1。则CH3COOH在水溶液中电离的ΔH等于_________
A.-67.7kJ·mol-1 B.-43.5kJ·mol-1 C.+43.5kJ·mol-1 D.+67.7kJ·mol-1
-
已知常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=﹣1275.6kJ/mol
②H2O(l)═H2O(g)△H=+44.0kJ/mol
写出甲醇燃烧的热化学方程式________.
-
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______________。
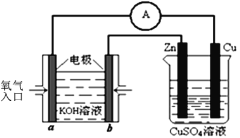
(2)利用甲醇燃料电池设计如下图所示的装置:则该装置中b极的电极反应式为_________________________; Zn极为_______极。
-
(10分)
甲醇是一种重要的化工原料。
(1)已知:① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H= -1275.6 kJ·mol—1
② H2O(l)= H2O(g) △H=+ 44.0 kJ·mol—1
写出表示甲醇燃烧热的热化学方程式 。
(2)甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景。其反应为:
CH3OH (g)+ H2O (g) CO2(g) +3H2 (g) △H=-72.0kJ/mol
CO2(g) +3H2 (g) △H=-72.0kJ/mol
①该反应的平衡常数表达式为__________________。
②下列措施中能使平衡时n(CH3OH)/n(CO2)减小的是(双选)___________。
A.加入催化剂 B.恒容充入He(g),使体系压强增大
C.将H2(g)从体系中分离 D.恒容再充入1molH2O(g)
(3)甲醇可以氧化成甲酸,在常温下用0.1000 mol/L NaOH溶液滴定20. 00 mL 0.1000 mol/L 甲酸溶液过程中,当混合液的pH=7时,所消耗的V(NaOH) _________ (填“<”或“>”或“=”) 20. 00 mL。
-
(1)甲醇是重要的可再生燃料。已知在常温常压下:
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g)ΔH=-1 275.6 kJ/mol
2CO(g)+O2(g)===2CO2(g) ΔH=-566.0 kJ/mol
H2O(g)===H2O(l) ΔH=-44.0 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________________。
(2)氧化还原反应与生产、生活、科技密切相关。请回答下列问题:
①银制器皿日久表面变黑是因为表面生成了Ag2S的缘故,该现象属于________腐蚀。如果加入一定浓度硝酸将发生反应3Ag2S+8HNO3===6AgNO3+3S↓+2NO↑+4H2O,同时Ag与硝酸反应生成AgNO3、NO、H2O,当生成22.4 mL的气体时,参加反应硝酸的物质的量为________。
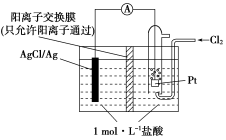

图1 图2
②在如图1所示的原电池装置中,负极的电极反应为______________,H+的移动方向为________;(填“从右向左”,“从左向右”)电池总反应方程式为___________________,当电路中转移0.1 mol e-时,交换膜左侧溶液中离子减少的物质的量为________。
③电解NO制备NH4NO3原理如图2所示,接电源正极的电极为________(填X或Y),X电极反应式为_________________,为使电解产物完全转化为NH4NO3,需要补充的物质A的化学式为_____________。
-
如图表示了298K时氮气与氢气合成氨反应过程中的能量变化,据此请回答:
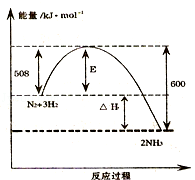
(1)写出氮气与氢气合成氨的热化学反应方程式: .
(2)已知在常温常压下:
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=﹣a kJ•mol﹣1
2CO(g)+O2(g)═2CO2(g)△H=﹣b kJ•mol﹣1
H2O(g)═H2O(l)△H=﹣c kJ•mol﹣1
则,CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H= kJ•mol﹣1.
-
已知:①2H2(g)+O2(g)=2H2O(l) ΔH=-571. 6kJ·mol-1
6kJ·mol-1
②2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452kJ· mol-1
mol-1
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1下列说法正确的是
A.H2(g)的燃烧热为571.6kJ·mol-1
B.H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)ΔH=-114.6kJ·mol-1
C.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
-
已知:①2H2(g)+O2(g)=2H2O(l) ΔH1=-571.6 kJ·mol-1
②2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH2=-1452 kJ·mol-1
③H+(aq)+OH-(aq)=H2O(l) ΔH3=-57.3 kJ·mol-1
下列说法正确的是( )
A. H2(g)的燃烧热为571.6 kJ·mol-1
B. 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.  H2SO4(aq)+
H2SO4(aq)+ Ba(OH)2(aq)=
Ba(OH)2(aq)= BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D. 3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+131.4 kJ·mol-1
CO2(g)+3H2(g) △H>0






