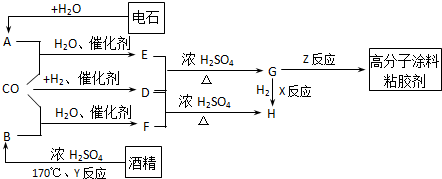
-
某温度下,反应N2O4(g)⇌2NO2(g)-Q在密闭容器中达到平衡.下列说法不正确的是( )
A.加压时(体积变小),将使正反应速率增大
B.保持体积不变,加入少许NO2,将使正反应速率减小
C.保持体积不变,加入少许N2O4,再达平衡时,颜色变深
D.保持体积不变,升高温度,再达平衡时颜色变深难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,11.2LNO与5.6LO2混合后的分子总数为0.5NA
B.1mol癸烷所含共价键数为29NA
C.1mol乙烯基所含电子数为16NA
D.乙烯和环丙烷组成的28g混合气体中含有4NA个氢原子难度: 中等查看答案及解析
-
维生素C又名抗坏血酸,具有酸性和强还原性,也是一种常见的食品和饮料的添加剂(如苹果汁等),其结构如图.下列有关说法正确的是( )
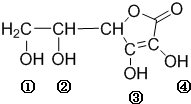
A.维生素C的分子式为C6H10O6
B.维生素C由于含有酯基而难溶于水
C.维生素C由于含有C=O键而能发生银镜反应
D.维生素C的酸性可能是由于③④两个羟基引起的难度: 中等查看答案及解析
-
下列操作中,完全正确的一组是( )
①用试管夹夹持试管,试管夹从试管底部上套,夹在试管中上部
②给盛有液体的体积不超过1/3容积的试管加热
③用饱和的Na2CO3溶液除去CO中的CO2
④将试管平放,用纸槽往试管里送人固体粉末后,然后竖立试管
⑤取用放在细口瓶的液体时,取下瓶塞倒立放在桌面上,倾倒液体时瓶上的标签对着地面
⑥将烧瓶放在桌上,用力塞紧塞子
⑦用坩埚钳夹取加热后的蒸发皿
⑧制取Fe(OH)2时将滴管垂直伸进试管内的液体中
⑨稀释浓硫酸时,把水迅速倒入盛有浓硫酸的量筒中
⑩检验装置的气密性时,把导管的一端浸入水中,用手捂住容器的外壁或用酒精灯微热.
A.①②④⑦⑧⑩
B.①④⑤⑦⑨⑩
C.①④⑤⑦⑧⑩
D.①②⑤⑦⑨难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O
B.甲酸溶液与滴入少量的新制氢氧化铜后共热:HCOOH+2Cu(OH)2Cu2O+CO2↑+3H2O
C.苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O2C6H5OH+CO32-
D.甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OHCO32-+2NH4++4Ag↓+6NH3+2H2O
难度: 中等查看答案及解析
-
图为电解饱和食盐水的简易装置,下列有关说法正确的是( )
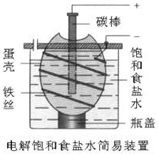
A.电解一段时间后,往蛋壳中溶液中滴加几滴酚酞,呈红色
B.蛋壳表面缠绕铁丝发生氧化反应
C.铁丝表面生成的气体能使湿润的淀粉碘化钾试纸变蓝
D.蛋壳可阻止生成的氯气与氢气、氢氧化钠溶液接触难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.等物质的量浓度NaCl和CH3COONa溶液等体积混合,
c(Cl-)>c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.25℃时,若10mL盐酸(pHa)与100mLBa(OH)2溶液(pHb)混合后恰好中和,则pHa+pHb=13
C.等物质的量浓度的硫酸与醋酸钠溶液等体积混合,c(SO42-)+c(OH-)=c(H+)+c(CH3COOH)
D.向氨水中加水稀释,减小
难度: 中等查看答案及解析