-
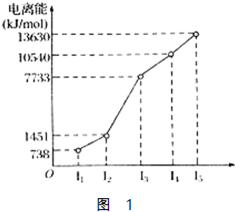
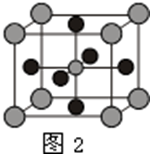
短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁原子最外层电子数与电子层数相等,则( )
A.原子半径:丙>乙>丁
B.单质的还原性:丁>丙>甲
C.甲、乙、丙的氧化物均为共价化合物
D.乙、丙、丁的最高价氧化物对应的水化物能相互反应难度: 中等查看答案及解析
-
反应①、②分别是从海藻灰和某种矿石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4═2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3═2Na2SO4+3NaHSO4+H2O+I2
下列说法正确的是( )
A.两个反应中均为硫元素被氧化
B.碘元素在反应①中被还原,在反应②中被氧化
C.氧化性:Mn02>SO42->I03->I2
D.反应①、②中生成等量的I2时转移电子数比为1:5难度: 中等查看答案及解析
-
在中性含有Na+的溶液中,还可能存在NH4+,Fe2+,Br-,CO2-3,I-,SO2-3六种离子中的一种或几种,进行如下实验:
(1)原溶液滴加足量氯水后,有气泡生成,溶液呈橙黄色;
(2)向橙黄色溶液中加BaCl2溶液无沉淀生成
(3)橙黄色溶液不能使淀粉变蓝
由此推断原溶液中一定不存在的离子是( )
A.NH4+,Br-,CO2-3
B.NH+4,I-,SO2-3
C.Fe2+,I一,CO2-3
D.Fe2+,I-,SO2-3难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.“光化学烟雾”“硝酸型酸雨”的形成都与氮氧化合物有关
B.根据分散质微粒直径大小可以将分散系分为溶液、胶体和浊液
C.SiO2可用于制造光导纤维,其性质稳定,不溶于强酸、强碱
D.焰火的五彩缤纷是某些金属元素的性质的展现难度: 中等查看答案及解析
-
下列化学用语使用不正确的是( )
A.Na+的结构示意图
B.纯碱的化学式为Na2CO3
C.聚乙烯的结构简式为CH2=CH2
D.高氯酸(HClO4)中氯元素的化合价为+7难度: 中等查看答案及解析
-
下列有关物质分类正确的是( )
①混合物:盐酸、王水、水玻璃、水银
②化合物:CaCl2、烧碱、聚苯乙烯、HD
③电解质:H2SO4、胆矾、冰醋酸、硫酸钡
④同素异形体:C60、C70、金刚石、石墨.
A.①③
B.②④
C.②③
D.③④难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.泥沙和水的混合物可以直接用分液漏斗分离
B.用水可以区分苯和四氯化碳
C.配制稀硫酸时,可在量筒中加入一定体积的水,再慢慢加入浓硫酸
D.用托盘天平称量11.72g氯化钾固体难度: 中等查看答案及解析
-
下列说法正确的是( )
A.乙醇的酯化反应和酯的水解反应均属于取代反应
B.石油的分馏和煤的干馏都是物理变化
C.可用氢氧化钠溶液除去乙酸乙酯中混有的乙酸和乙醇
D.蛋白质、淀粉、油脂均属于天然高分子化合物,均能发生水解反应难度: 中等查看答案及解析
-
C、N、S都是重要的非金属元素.下列说法正确的是( )
A.三者对应的氧化物均为酸性氧化物
B.三者的单质直接与氧气反应都能至少生成两种氧化物
C.相同温度下,等物质的量浓度的Na2CO3、NaNO3、Na2SO3溶液的pH大小顺序:NaNO3<Na2S03<Na2CO3
D.CO2、NO2、SO2都能与H2O反应,其反应原理相同难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.lmol氧气与金属钠反应,氧气得到的电子数一定是4NA
B.常温下,92gNO2和N2O4混合气体中含有氧原子数为2NA
C.在H2O2+Cl2═2HCl+O2反应中,每生成16g氧气,则转移电子数为2NA
D.100mL18.4mol•L-1的硫酸与足量铜反应,生成二氧化硫的分子数小于0.92NA难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.以石墨作电极电解CuCl2溶液:2Cl-+2H2O2OH-+Cl2↑十H2↑
B.FeSO4溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+═2Fe3++2H2O
C.铜跟浓硝酸反应:Cu+4HNO3(浓)═Cu2++2NO3-+2NO↑+2H2O
D.NaHSO4溶液与足量Ba(OH)2溶液混合:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O难度: 中等查看答案及解析
-
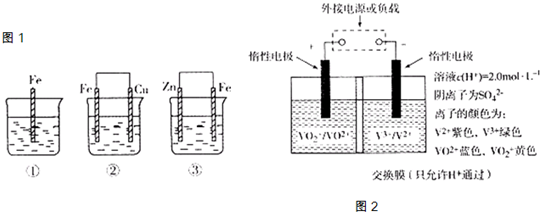
关于下列各装置图的叙述中,不正确的是( )
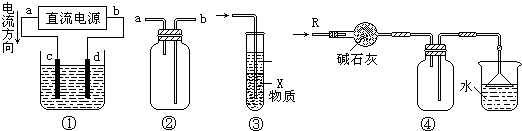
A.装置①中,d为阳极、c为阴极
B.装置②可用于收集H2、CO2、Cl2、HCl、NO2等气体(必要时可添加尾气处理装置)
C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并能防止倒吸
D.装置④可用于干燥、收集氨气,并吸收多余的氨气难度: 中等查看答案及解析
-
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
下列说法错误的是( )物质 X Y Z 初始浓度/mol•L-1 0.1 0.2 平衡浓度/mol•L-1 0.05 0.05 0.1
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y⇌2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数难度: 中等查看答案及解析
-
向一定量的Fe、FeO和Fe2O3的混合物中加入120mL 4mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为( )
A.0.24 mol
B.0.21 mol
C.0.16 mol
D.0.14 mol难度: 中等查看答案及解析
-
常温下MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是( )

A.ROH是一种强碱
B.等物质的量浓度的MOH与盐酸反应,所得溶液呈中性,则MOH的体积大于盐酸的体积
C.在x点,c(M+)=c(R+)
D.稀释前,c(ROH)=10 c(MOH)难度: 中等查看答案及解析