-
在物质结构研究的历史上,首先提出原子内有电子学说的科学家是( )
A.道尔顿 B.卢瑟福 C.汤姆生 D.波尔
难度: 简单查看答案及解析
-
按能量由低到高的顺序排列,正确的一组是( )
A.1s、2p、3d、4s B.1s、2s、3s、2p
C.2s、2p、3s、3p D.4p、3d、4s、3p
难度: 简单查看答案及解析
-
下列各原子或离子的电子排布式错误的是( )
A.K+:1s22s22p63s23p6 B.F:1s22s22p5
C.S2—:1s22s22p63s23p4 D.Ar:1s22s22p63s23p6
难度: 中等查看答案及解析
-
下列有关电子云和原子轨道的说法正确的是( )
A.原子核外的电子象云雾一样笼罩在原子核周围,故称电子云
B.s能级的原子轨道呈球形,处在该轨道上的电子只能在球壳内运动
C.p能级的原子轨道呈纺锤形,随着电子层的增加,p能级原子轨道也在增多
D.与s原子轨道的电子相同,p原子轨道电子的平均能量随能层的增大而增加
难度: 中等查看答案及解析
-
第四周期元素原子中未成对电子数最多可达( )
A.4个 B.5个 C.6个 D.7个
难度: 简单查看答案及解析
-
下列分子中存在p键的是( )。
A.PCl3 B.HCl C.H2 D.N2
难度: 中等查看答案及解析
-
下列各组化合物分子中,键角大小顺序正确的是( )
A.BeCl2>BF3>CH4>NH3 B.CH4>NH3=BF3>BeCl2
C.BeCl2>BF3=NH3>CH4 D.NH3>CH4>BeCl2>BF3
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.离子晶体中只存在离子键
B.稀有气体形成的晶体属于分子晶体
C.干冰升华时,分子内共价键会发生断裂
D.由非金属元素形成的化合物一定是共价化合物
难度: 中等查看答案及解析
-
下列B组中命题正确且能用A组命题加以正确解释的是( )
A组
B组
Ⅰ.H—I键键能大于H—Cl键键能
Ⅱ.H—I键键能小于H—Cl键键能
Ⅲ.HI分子间作用力大于HCl分子间作用力
Ⅳ.HI分子间作用力小于HCl分子间作用力
①HI比HCl稳定
②HI比HCl不稳定
③HI沸点比HCl高
④HI沸点比HCl低
A.Ⅰ、① B.Ⅳ、② C.Ⅲ、③ D.Ⅱ、④
难度: 中等查看答案及解析
-
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p3;④1s22s22p5。则下列有关比较中正确的是( )
A.第一电离能:④>③>②>① B.原子半径:④>③>②>①
C.电负性:④>③>②>① D.最高正化合价:④>③=②>①
难度: 中等查看答案及解析
-
下列分子中,所有原子都满足最外层为8电子结构的是( )
A.BF3 B.PCl5 C.HCl D.CF2Cl2
难度: 中等查看答案及解析
-
下面图像是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断属于NaCl晶体结构的是( )
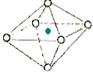
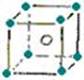

① ② ③ ④
A.①和④ B.②和③ C.①和③ D.②和④
难度: 中等查看答案及解析
-
根据等电子原理,等电子体之间结构相似、物理性质也相近。以下各组粒子不能互称为等电子体的是
A.CO和N2 B.O3和SO2 C.CO2和N2O D.N2H4和C2H4
难度: 中等查看答案及解析
-
“类推”是常用的学习方法,但有时会产生错误结论。下列类推的结论中,正确的是
A.ⅣA族元素氢化物沸点顺序是GeH4 >SiH4 >CH4;则ⅤA族元素氢化物沸点顺序也是AsH3 >PH3 >NH3
B.第二周期元素氢化物稳定性顺序是HF >H2O >NH3;则第三周期元素氢化物稳定性顺序也是HCl >H2S >PH3
C.晶体中有阴离子,必有阳离子;则晶体中有阳离子,也必有阴离子
D.干冰(CO2)是分子晶体;则二氧化硅(SiO2)也是分子晶体
难度: 困难查看答案及解析
-
在乙烯分子中有5个σ键、一个π键,它们分别是
A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键
B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
C.C-H之间是sp2形成的σ键,C-C之间是未参加杂化的2p轨道形成的π键
D.C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键
难度: 中等查看答案及解析
-
在下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是
A.Cl2+H2O=HCl+HClO B.2Na2O2+2CO2=2Na2CO3+O2
C.Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑ D.NaOH+HNO3=NaNO3+H2O
难度: 中等查看答案及解析
-
下列有关叙述正确的是
A.氢键是一种特殊化学键,它广泛地存在于自然界中
B.在
分子中含有1个手性C原子
C.碘单质在水溶液中溶解度很小是因为I2和H2O都是非极性分子。
D.含氧酸可用通式XOm(OH)n来表示,若n值越大,则含氧酸的酸性越大
难度: 中等查看答案及解析
-
下列各组分子中,中心原子均采取sp3不等性杂化的是
A.PCl3、NH3 B.BF3、H2O C.CCl4、H2S D.BeCl2、BF3
难度: 中等查看答案及解析
-
下列现象与氢键有关的是
①NH3的熔、沸点比VA族其他元素氢化物的高
②C原子个数小于4的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④尿素的熔、沸点比醋酸的高
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
⑥水分子在高温下也很稳定
A.①②③④⑤⑥ B.①②③④⑤ C.①②③④ D.①②③
难度: 中等查看答案及解析
-
氮化硼是一种新合成的结构材料,它是超硬、耐磨,耐高温的物质,下列各组物质熔化时所克服的粒子间的作用与氮化硼熔化时所克服的粒子间作用相同的是
A.C60和金刚石 B.晶体硅和水晶 C.冰和干冰 D.碘和金刚砂
难度: 中等查看答案及解析