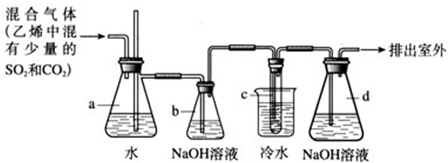
-
元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构.下列推测不正确的是( )
A.同周期元素中X的金属性最强
B.原子半径X>Y,离子半径X+>Z2-
C.同族元素中Z的氢化物稳定性最高
D.同周期元素中Y的最高价含氧酸的酸性最强难度: 中等查看答案及解析
-
近几年,我国的航天事业成就斐然,“神舟六号”载人飞船已发射成功,“嫦娥”探月工程也在稳步进行中.据科学家预测,月球的土壤中吸附着数百万吨的3He,每百吨3He核聚变所释放出的能量相当于目前人类一年消耗的能量.在地球上,该元素主要以4He的形式存在.下列说法正确的是( )
A.4He原子核内含有4个质子
B.3He和4He互为同位素
C.3He原子核内含有3个中子
D.4He的最外层电子数为2,所以4He具有较强的金属性难度: 中等查看答案及解析
-
下列反应既是氧化还原反应,又是放热反应的是( )
A.铝片与稀硫酸反应
B.Ba(OH)2•8H2O与NH4Cl反应
C.灼热的炭与二氧化碳反应
D.氢氧化钠与盐酸的中和反应难度: 中等查看答案及解析
-
把a、b、c、d 4块金属片浸入稀硫酸中,用导线两两相连组成原电池.若a、b相连时,a为负极;c、d相连时,d上产生大量气泡;a、c相连时,电流由c经导线流向a;b、d相连时,电子由d经导线流向b,则此4种金属的活动性由强到弱的顺序为( )
A.a>b>c>d
B.a>c>d>b
C.c>a>b>d
D.b>a>c>d难度: 中等查看答案及解析
-
下列叙述中错误的是( )
A.化石能源物质内部蕴藏着大量的能量
B.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来
C.物质的化学能可以在不同条件下转化为热能、电能
D.吸热反应没有利用价值难度: 中等查看答案及解析
-
等质量的下列各烃完全燃烧时,消耗氧气最多的是( )
A.CH4
B.C2H6
C.C3H6
D.C6H6难度: 中等查看答案及解析
-
下列各项中表达正确的是( )
A.F-的结构示意图:
B.NH4Cl的电子式: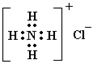
C.NaCl的电子式:
D.乙烯的结构简式:CH2CH2难度: 中等查看答案及解析
-
下列各组性质比较中不正确的是( )
A.酸性HClO4>HBrO4>HIO4
B.碱性KOH>Ca(OH)2>Mg(OH)2
C.还原性F->Cl->Br-
D.稳定性HCl>H2S>PH3难度: 中等查看答案及解析
-
某元素原子的质量数为A,它的阴离子Xn-核外有x个电子,w克这种元素的原子核内中子数为( )
A.
B.
C.
D.难度: 中等查看答案及解析
-
下列各组物质中互为同分异构体的是( )
A.O2和O3
B.CH2=CH2和CH2=CH-CH3
C.CH3-CH2-CH2-CH2-CH3和
D.和
难度: 中等查看答案及解析
-
常用的钮扣电池为银锌电池,它分别以锌和氧化银为电极.放电时锌极上的电极反应是:Zn+2OH--2e=Zn(OH)2,氧化银电极上的反应是:Ag2O+H2O+2e=2Ag+2OH-,下列判断中,正确的是( )
A.锌是负极,发生氧化反应,氧化银是正极,发生还原反应
B.锌是正极,发生氧化反应,氧化银是负极,发生还原反应
C.锌是正极,发生还原反应,氧化银是负极,发生氧化反应
D.锌是负极,发生还原反应,氧化银是正极,发生氧化反应难度: 中等查看答案及解析
-
在恒温、恒容的密闭容器内进行反应A(g)⇌B(g)+C(g),正反应为放热反应.若反应物A的浓度由2mol/L降到0.8mol/L需20s,那么反应物A的浓度由0.8mol/L降到0.2mol/L所需反应时间为( )
A.大于10s
B.10s
C.小于10s
D.无法判断难度: 中等查看答案及解析
-
在一定的温度下,可逆反应A(g)+3B(g)
2C(g) 达到平衡的标志是( )
A.单位时间生成nmolA,同时生成nmolC
B.A、B、C的分子数之比为1:3:2
C.单位时间生成nmolA,同时生成3nmolB
D.A、B、C的浓度不再变化难度: 中等查看答案及解析
-
下列烷烃:①正己烷 ②乙烷 ③正丁烷 ④异丁烷 中,沸点由高到低的顺序正确的是( )
A.①②③④
B.①④③②
C.③④①②
D.①③④②难度: 中等查看答案及解析
-
某气态烷烃20mL,完全燃烧时,正好消耗同温同压下的氧气100mL,该烃的化学式是( )
A.C2H6
B.C2H4
C.C3H8
D.C4H10难度: 中等查看答案及解析
-
a、b、c、d、e是同周期的五种元素,a和b的最高价氧化物对应水化物呈碱性,且碱性b>a;c和d的气态氢化物的还原性d>c;五种元素的原子得失电子后所形成的简单离子中e的离子半径最小,则它们的原子序数由小到大的顺序是( )
A.b、a、d、c、e
B.e、b、a、d、c
C.b、a、e、d、c
D.c、d、e、a、b难度: 中等查看答案及解析