-
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的的是
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④ B.③④⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.⑤⑥⑦⑧
难度: 简单查看答案及解析
-
用相对分子质量为43的烷基取代甲苯苯环上的一个氢原子所得芳香烃产物的数目为
A.3种 B.4种 C.5种 D.6种
难度: 中等查看答案及解析
-
下列叙述正确的是
A.将AlCl3溶液和NaAlO2溶液分别蒸干后灼烧,所得固体产物均为Al2O3
B.对于可逆反应N2(g)+3H2(g)
2NH3(g)增大氮气浓度可增加活化分子百分数,从而使反应速率增加
C.室温下,向Mg(OH)2中加入饱和氯化铵溶液能使Mg(OH)2溶解
D.恒容密闭容器中进行的反应3A(g)
B(g)+C(g),在其它条件不变情况下,再充入一定量的A气体,A的转化率将减小
难度: 中等查看答案及解析
-
下列各组离子在指定溶液中,一定能大量共存的是
①c(H+)=10-12 mol·L-1的溶液中:I-、NO3-、SO32-、K+
②中性溶液中:Fe3+、NO3-、Na+、SO42-
③由水电离出的c(H+)=10-12mol/L的溶液:Ba2+、Na+、NO3-、Cl-
④使甲基橙变黄色的溶液中:CO32-、Na+ 、AlO2-、SO42-
A.①③ B.①④ C.②③ D.③④
难度: 中等查看答案及解析
-
下列说法正确的是
A.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
B.物质的量浓度相同的磷酸钠(Na3PO4)溶液和磷酸(H3PO4)溶液中PO43-的物质的量浓度相同
C.足量Zn分别和等体积、等物质的量浓度的盐酸和醋酸反应时,产生H2的量相同,放出H2的速率不等。
D.因为CH3COOH是弱电解质,HCl是强电解质,所以中和等体积等物质的量浓度的醋酸和盐酸时,中和醋酸消耗的NaOH比盐酸消耗的NaOH用量少
难度: 中等查看答案及解析
-
“暖宝宝”的主要原料有铁粉、活性炭、水、食盐等,其中活性炭是原电池的电极之一,食盐的作用是溶于水形成电解质溶液.下列有关“暖宝宝”的说法错误的是
A.“暖宝宝”使用前要密封保存,使之与空气隔绝
B.“暖宝宝”放出的热量是铁发生氧化反应时产生的
C.活性炭作用是作原电池正极,加速铁粉的氧化
D.活性炭最终将转化为二氧化碳
难度: 中等查看答案及解析
-
下列说法错误的是
A.萃取操作时,选择有机萃取剂,则溶质在萃取剂的溶解度必须比水大
B.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
C.蒸馏操作时,应使温度计水银球插入混合溶液的液面下
D.配制一定物质的量浓度的溶液时,洗涤烧杯和玻璃棒的溶液必须转入容量瓶中
难度: 中等查看答案及解析
-
在2L恒容密闭容器中充入2 mol X和1mol Y发生反应:2X(g)+Y(g)
3Z(g)△H<0反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。
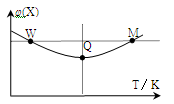
下列推断正确的是
A.升高温度,平衡常数增大
B.W点X的正反应速率等于M点X的正反应速率
C.Q点时,Y的转化率最大
D.平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大
难度: 中等查看答案及解析
-
下列溶液中有关物质的量浓度关系不正确的
A.pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+)=c(OH-)+c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D.0.1 mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(A2-)>c(H2A)
难度: 困难查看答案及解析
-
下列有关化学用语正确的是
①乙烯的最简式C2H4
②乙醇的结构简式C2H6O
③四氯化碳的电子式
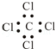
④乙炔的结构简式CHCH
⑤乙烷的结构式CH3CH3
⑥乙醛的结构简式CH3COH.
A.全对 B.全错 C.③④⑤ D.③④⑥
难度: 简单查看答案及解析
-
有4种混合溶液,分别由等体积0.1 mol·L-1的2种溶液混合而成:①CH3COONa与NaCl;②CH3COONa与NaOH;③CH3COONa与NaHSO4;④CH3COONa与NaHCO3,c(CH3COO-)排序正确的是
A.②>④>①>③ B.②>④>③>①
C.③>①>②>④ D.①>④>③>②
难度: 中等查看答案及解析
-
运用相关化学知识进行判断,下列结论错误的是
A.某吸热反应能自发进行,因此该反应是熵增反应
B.常温下, 0.1 mol/L氨水(电离度α=1%)的pH为11
C.用蒸馏水润湿的试纸测溶液的pH,不一定会使结果偏低
D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
难度: 中等查看答案及解析
-
下列系统命名正确的是
A.2-甲基-4-乙基戊烷 B.3,4,4-三甲基己烷
C.2,3-二乙基-1-戊烯 D.间二甲苯
难度: 中等查看答案及解析
-
在核磁共振氢谱中出现两组峰,其氢原子数之比为3:2的化合物是
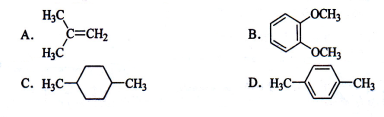
难度: 中等查看答案及解析
-
在恒温、恒压下,a mol A和b molB在一个容积可变的容器中发生反应:
A(g)+2B(g)
2C(g),一段时间后达到平衡,生成n mol C。下列说法正确的
A.物质A、B的转化率之比为l︰ 2
B.起始时刻和达到平衡后容器中的压强之比为(a+b)︰(a+b-
)
C.当v正(A)=2v逆(B)时,反应一定达到平衡状态
D.充入惰性气体,平衡向逆反应方向移动
难度: 中等查看答案及解析
-
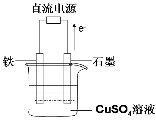
在下列装置中,MSO4和NSO4是两种常见金属的易溶盐。当K闭合时,SO42-从右到左通过交换膜移向M极,下列分析正确的是
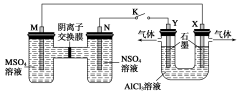
A.溶液中c(M2+)减小
B.N的电极反应式:N===N2++2e-
C.X电极上有H2产生,发生还原反应
D.反应过程中Y电极周围生成白色胶状沉淀
难度: 中等查看答案及解析