-
将纯水加热至较高温度,下列叙述正确的是( )
A. 水的离子积变大、pH变小、呈酸性
B. 水的离了积不变、pH不变、呈中性
C. 水的离子积变小、pH变大、呈碱性
D. 水的离子积变大、pH变小、呈中性
难度: 简单查看答案及解析
-
下列过程或现象与盐类水解无关的是( )
A. 纯碱溶液去油污 B. 铁在潮湿的环境下生锈
C. 加热氯化铁溶液颜色变深 D. 浓硫化钠溶液有臭味
难度: 中等查看答案及解析
-
下列物质,属于强电解质的( )
A. NH3.H2O B. H2O
C. CH3COONH4 D. CH3COOH
难度: 简单查看答案及解析
-
下列各电离方程式中,书写正确的是( )
A. H2S
2H++S2﹣ B. KHSO4
K++H++SO42﹣
C. Al(OH)3═Al3++3OH﹣ D. NaH2PO4═Na++H2PO4﹣
难度: 中等查看答案及解析
-
已知0.1mol/L的醋酸溶液中存在电离平衡: CH3COOH
CH3COO-+H+ 要使溶液中c(H+)/c(CH3COOH)比值增大,可以采取的措施是
A. 加少量CH3COONH4固体 B. 降低温度 C. 加少量NaCl固体 D. 升高温度
难度: 中等查看答案及解析
-
已知25℃时,下列酸的电离常数:醋酸: 1.75×10-5 、 氢氰酸:4.93×10-10、氢氟酸:7.2×10-4、甲酸:1.77×10-4。电离常数越大,对应酸的酸性越强。则物质的量浓度均为0.1mol·L-1的上述溶液酸性最强的是( )
A. 醋酸 B. 氢氰酸 C. 氢氟酸 D. 甲酸
难度: 简单查看答案及解析
-
pH=1的两种溶液A、B各1mL,分别加水稀释到1000mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图示,下列说法正确的是( )
①若 a<4,则A、B都是弱酸
②稀释后,A酸溶液的c(H+ )比B酸溶液c(H+ )大
③若a=4,则A是强酸,B是弱酸
④A、B两种酸溶液的物质的量浓度一定相等.
A. ①④ B. ②③ C. ①② D. ②④
难度: 困难查看答案及解析
-
下列有关实验的说法正确的是
A.用干燥的pH试纸测定新制氯水的pH
B.若25.00 mL滴定管中液面的位置在刻度为3.00mL处,则滴定管中液体的体积一定大于22.00mL
C.中和滴定实验中,洗净后的锥形瓶一定要用待测液润洗2-3次
D.用玻璃棒蘸取溶液滴在表面皿上的己润湿pH试纸上测其pH,一定有误差
难度: 简单查看答案及解析
-
常温下,某溶液中由水电离产生的H+的浓度为1×10-5moL/L,则该溶液中的溶质可能是下列物质中的( )
A. HCl B. NaHSO4 C. Na2CO3 D. NaCl
难度: 中等查看答案及解析
-
准确量取25.00 mL高锰酸钾溶液,可选用的仪器是( )
A. 50 mL量筒 B. 10 mL量筒C.50 mL酸式滴定管 D.50 mL碱式滴定管
难度: 简单查看答案及解析
-
常温时,将pH=3的盐酸和pH=11的氨水等体积混合后,所得溶液的pH( )
A. 等于7 B. 大于7 C. 小于7 D. 无法确定
难度: 中等查看答案及解析
-
下列溶液中浓度关系正确的是( )
A. 小苏打溶液中:c(Na+)+c(H+)=c(HCO)+c(CO
)+c(OH-)
B. CH3COONa溶液中:c(CH3COO-)>c(Na+)
C. 物质的量浓度相等的CH3COOH溶液和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D. 0.1 mol/L的NaHA溶液,其pH=4,则c(HA-)>c(H+)>c(H2A)>c(A2-)
难度: 困难查看答案及解析
-
常温下,在20.00 mL 0.100 0 mol·L-1 NH3·H2O溶液中逐滴滴加0.100 0 mol·L-1 HCl溶液,溶液pH随滴入HCl溶液体积的变化曲线如右图所示。下列说法正确的是
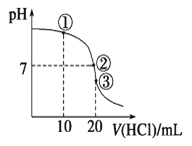
A.①溶液:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.②溶液:c(NH4+)=c(Cl-)>c(OH-)=c(H+)
C.①、②、③三点所示的溶液中水的电离程度②>③>①
D.滴定过程中不可能出现:c(NH3·H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+)
难度: 极难查看答案及解析
-
在蒸发皿中用酒精灯加热蒸干下列物质的溶液然后灼烧,可以得到该物质固体的是( )
A. AlCl3 B. Na2SO3 C. KMnO4 D. MgSO4
难度: 中等查看答案及解析
-
已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,下列排序正确的是( )
A. c(OH-)>c(HA)>c(HB)>c(H+) B. c(OH-)>c(A-)>c(B-)>c(H+)
C. c(OH-)>c(B-)>c(A-)>c(H+) D. c(OH-)>c(HB)>c(HA)>c(H+)
难度: 中等查看答案及解析
-
相同温度下,物质的量浓度相同的四种溶液:①CH3COONa ;②Na2CO3;③NaCl;④Na2SiO3,按pH由大到小的顺序排列正确的是( )
A. ④②①③ B. ①④③② C. ①②③④ D. ④③①②
难度: 中等查看答案及解析
-
常温时,将足量的AgCl分别加入下列各溶液中,AgCl的溶解度最小的是 ( )
A. 15mL 1.5 mol·L-1的AgNO3溶液 B. 10mL 2 mol·L-1的NaCl溶液
C. 5mL 1 mol·L-1的AlCl3溶液 D. 5mL 1.4 mol·L-1的BaCl2溶液
难度: 中等查看答案及解析
-
化学上常认为残留在溶液中的离子浓度小于1×10﹣5 mol·L﹣1时,沉淀就达完全.已知:常温下Ksp[M(OH)2]=1×10﹣21.则溶液中M2+沉淀完全时的pH为( )
A. 7 B. 6 C. 5 D. 4
难度: 简单查看答案及解析