-
SO2是一种酸性氧化物,溶于水生成亚硫酸。某同学对SO2的氧化性和亚硫酸的酸性进行了探究。回答下列问題:
(一)SO2的制备
该同学制备SO2的实验装置如下:
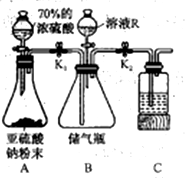
(1)装置A中发生反应的化学方程式为__________________________________________。
(2)装置C中盛有的是NaOH溶液,其作用是_________________________。
(二)验证SO2氧化性
待装置B中收集满SO2后,夹紧止水夹K1和K2取下装置 B,利用收集到的SO2验证其氧化性。
(3)设计一种验证SO2具有氧化性的方法:__________________________________________(要体现所使用检验试剂的名称和实验现象等要点)。
(4)将溶液R(足量)加人装置B的储气瓶中可将SO2排出进入检验试剂中,则溶液R是________。
(三)探究H2SO3的酸性强于HClO
由于次氯酸盐具有较强的氧化性,故不能直接将SO2通入次氯酸盐中检验H2SO3的酸性强于HClO,该同学用装置B中收集到的SO2,利用下面装置间接地完成了验证。
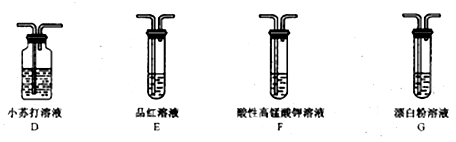
(5)装置的连接顺序为B→______________,F的作用是______________________________。
(6)可证明H2SO3的酸性强于HClO的实验现象是___________________________。
-
乙酸是一种重要的有机酸,在工业合成和医学上有重要的用途。
回答下列问题:
(1)乙酸俗称______________。
(2)CH3COOH(I)、C(s)、H2(g)的燃烧热△H分别为-870.3kJ·mol-1、-393.5 kJ·mol-1、-285.8 kJ·mol-1,则反应2C(s)+2H2(g)+O2(g)=CH2COOH(I)的△H=______________。
(3)乙酸和乙酸钠按一定比例混合可制成治疗酸中毒或碱中毒的缓冲溶液。
①用离子方程表示该缓冲溶液能治疗碱中毒的原因:____________________________。
②常温下,体积为1L,浓度为0.1mol·L-1的乙酸电离度为1.3%,该温度下乙酸的电离平衡参数值为__________________(水的电离忽略不计,结果保留两位有效数字);向该溶液中加入_______molCH3COONa可使溶液的pH约为4(溶液体积变化忽略不计)。
(4)已知乙酸蒸气中存在乙酸二聚物,二者如下平衡:(CH3COOH)2(g) 2CH3COOH(g) △H。
2CH3COOH(g) △H。
实验测定该平衡体系的 随温度和压强的变化如图所示:
随温度和压强的变化如图所示:

①上述反应的△H_____(填“>”或“<”)0,a、b、c三点中平衡常数最大的点是______。
②测定乙酸的摩尔质量应选择的适宜条件是________________。
-
碳酸锰(MnCO3)常用于脱硫的催化剂。工业上利用软锰矿(主要成分是MnO2,还含有钙、铁、铝镁的氧化物及一些重金属的氧化物)制备无水碳酸锰的工艺流程如下:
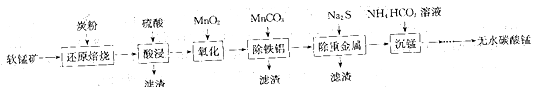
回答下列问题:
(1)为了提高“酸浸”步骤中原料的浸出率,可以采取的措施有___________(填字母)。
a.适当升温 b.连续搅拌 c.研磨矿石 d.加入足量的水
(2)“氧化”步骤中利用MnO2将溶液中Fe2+氧化为Fe3+,反应的离子方程式为_____________。
(3)“除铝铁”步骤中用MnCO3调节溶液pH的优点是___________________(写出一点),也可以用(填化学式)_____________代替MnCO3。
(4)“沉锰”步骤中反应温度需要控制在30~35℃以下,反应温度控制在35℃以下的原因是____,写出“沉锰”步骤中发生反应的化学方程式:________________________。
(5)25℃时,Ksp(MnCO3)=2.2×10-11,Ksp(MgCO3)=6.8×10-6。“沉锰”步骤中当Mn2+刚好沉淀完全[c(Mn2+)=1×10-5mol·L-1]时,若不析出MgCO3沉淀,则此时c(Mg2+)不能超过_____________mol·L-1(计算结果保留1位小数)。
-
[化学——选修3:物质结构与性质]
黄铜专指铜锌合金,始于明代《明会典》,古代黄铜主要用于铸币和铸造雕塑。回答下列问题:
(1)Zn元素在周期表中的位置为_____________,基态Zn2+外围电子排布式为_____________。
(2)硝酸铜溶液可与乙二胺( )形成配位化合物[Cu(en)2](NO3)2(“en”表示乙二胺)。
)形成配位化合物[Cu(en)2](NO3)2(“en”表示乙二胺)。
①NO3-的空间构型为_____________。
②Cu2+与乙二胺分子之间存在的化学键类型为______________,在乙二胺分子中提供孤电子对的原子是_____________。
③在乙二胺分子中C的杂化轨道类型是_____________。
④乙二胺的沸点116℃,而相对分子质量比乙二胺大1的三甲胺( )的沸点只有2.87℃,其原因是___________________________________。
)的沸点只有2.87℃,其原因是___________________________________。
(3)铜的晶胞实物堆积模型如图所示,设铜的密度为ρg·cm-3。

①铜的晶体堆积方式为_____________。
②铜晶胞参数a=_____________cm(列出式子即可,设铜的摩尔质量为Mg·mol-1,阿伏伽德罗常数值为NA)。
-
[化学——选修5:有机化学基础]
酯中的OR′被一个醇(或酚)的OR″置换的反应称为酯交换反应(ester exchange)。
RCOOR′+R″OH RCOOR″+R′OH
RCOOR″+R′OH
该反应在生物柴油、高分子材料合成等方面具有重要价值。下面是以乙烯为原料,利用酯交换反应合成高分子材料PC和PET的一种合成路线(部分产物及反应条件已略去):

回答下列问题:
(1)A是一种三元环状化合物,且由乙烯生成A时反应的原子利用率为100%,则A的结构简式为_____________。
(2)“双酚A”的结构简式为__________,高分子材料PC中所含官能团的名称是__________。
(3)由B→C的反应类型是_____________,由G→PET聚酯的反应类型是_____________。
(4)由E→F得化学方程式为_______________________________________________。
(5)满足如下条件的对苯二甲酸二甲酯的同分异构体共有_____________种,其中核磁共振氢谱有4组峰,且峰面积之比为1∶1∶1∶2的同分异构体的名称为_____________。
①苯环上的一氯代物只有两种
②苯环上的取代基不超过三个
③0.1mol该有机物与足量的碳酸氢钠溶液反应,能产生4.48L(标准状况下)CO2
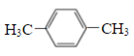
(6)参照 的合成方法,设计一条由2-溴丙烷和必要的无机试剂制备
的合成方法,设计一条由2-溴丙烷和必要的无机试剂制备 的合成路线:_________________________。
的合成路线:_________________________。
减小
增大






 的合成路线:_________________________。
的合成路线:_________________________。