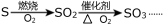-
化学与生产、生活密切相关。下列叙述正确的是
A.碳酸氢钠是焙制糕点的发酵粉的一种成分
B.CO、NO、NO2都是大气污染物,在空气中都能稳定存在
C.光导纤维和玻璃都是硅酸盐产品
D.明矾能作净水剂,因为它能与水反应生成强氧化性的氢氧化铝胶体
难度: 中等查看答案及解析
-
下列说法正确的是
A.L层上的电子数为奇数的元素一定是主族元素
B.族序数等于周期序数的元素一定是金属元素
C.由不同种元素组成的多原子分子里,一定只存在极性键
D.共价化合物只含有共价键,离子化合物只含有离子键
难度: 中等查看答案及解析
-
四种短周期元素形成的简单离子X-、Y2-、Z+、W2+具有相同的电子层结构,下列说法正确的是
A.原子序数:X<Y<Z<W B.单质的熔点:W>Z
C.热稳定性:H2Y>HX D.碱性:W(OH)2>ZOH
难度: 中等查看答案及解析
-
下列各组大小关系比较中错误的
A.热稳定性:Na2CO3>NaHCO3 B.酸性:H2CO3>HClO
C.氧化性:浓硝酸>稀硝酸 D.结合OH- 的能力:NH4+>Al3+
难度: 中等查看答案及解析
-
设阿伏加德罗常数的数值为NA,下列说法不正确的是
A.1.6 g CH4中含有的C—H键数目为0.4 NA
B.0.1 mol CaO2中含有的阴、阳离子总数为0.2 NA
C.加热条件下足量的铜粉与含0.2 mol H2SO4的浓硫酸充分反应,转移电子数目为0.2 NA
D.标准状况下,2.24 L H37Cl含有的中子数为2.0 NA
难度: 中等查看答案及解析
-
下列分子中每个原子最外层都达到8电子稳定结构的是
A.PCl3 B. H2O2 C.NO D.BF3
难度: 中等查看答案及解析
-
下列关于物质检验或鉴别的说法错误的是
A.用CCl4鉴别溴水和碘水
B.用AgNO3溶液鉴别溴化钾溶液和氯化钠溶液
C.向某盐溶液中加入氢氧化钠溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,溶液中一定有NH4+
D.向某盐溶液中,加入盐酸,产生使澄清石灰水变浑浊的气体,溶液中含有大量CO32-离子
难度: 中等查看答案及解析
-
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
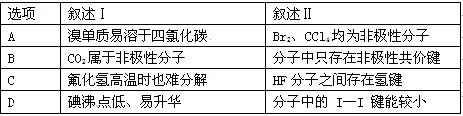
难度: 中等查看答案及解析
-
下列除去杂质(括号里的为杂质)的试剂中正确的是
A.Cl2(HCl):饱和NaHCO3
B.NaCl溶液(Na2SO4):Ba(NO3)2溶液
C.NO(NO2):水
D.Al2O3(SiO2):NaOH溶液
难度: 中等查看答案及解析
-
下列化学用语中正确的是
A.NH4HCO3溶液中加入足量的NaOH浓溶液:NH4+ + OH- = NH3↑ + H2O
B.向FeBr2溶液中滴加少量氯水:2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
C.用电子式表示HCl的形成过程:
D.硫磺在空气中燃烧:2S + 3O2
2SO3
难度: 中等查看答案及解析
-
下列物质化学性质的说法正确的是
A.SO2、CO2性质相似,都能在水溶液中被氯气氧化
B.Na2O2、Na2O组成元素相同,与CO2反应产物也相同
C.Mg和K在一定条件下与水反应都生成H2和对应的碱
D.Na、Li同属于碱金属单质,在加热条件下与氧气反应都生成过氧化物
难度: 中等查看答案及解析
-
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是

难度: 中等查看答案及解析
-
假设化学相互作用包括共价键、离子键、范德华力、氢键,下列各组中两种晶体熔化时需要破坏的化学相互作用种类相同的是
A.C2H5OH(乙醇) 、KOH B.金刚石、MgF2
C.H2SO4、Na2SO4 D.P4和CCl4
难度: 中等查看答案及解析
-
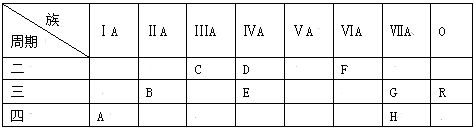
根据表中短周期元素性质的数据判断,下列说法一定错误的是
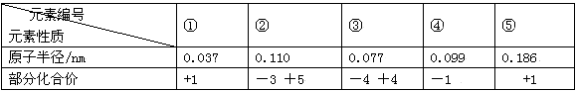
A.④是周期表中非金属性最强的元素
B.①是周期表中原子半径最小的元素
C.②④⑤在位于同一个周期
D.①③两元素组成的化合物分子与③④两元素组成的化合物分子空间构型相同
难度: 困难查看答案及解析
-
下表各组物质中,在一定条件下,物质之间不可能实现如图所示转化的是
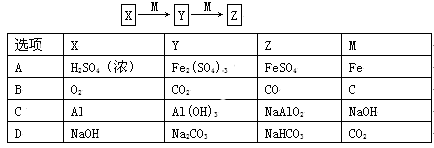
难度: 困难查看答案及解析
-
下列实验装置正确且能达到实验目的的是
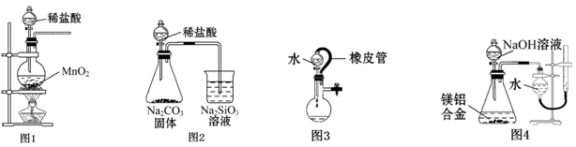
A.用图1所示装置制取少量Cl2
B.用图2所示装置证明非金属性Cl>C>Si
C.图3所示装置中水不能持续流下,说明装置气密性良好
D.用图4所示装置测定镁铝合金中铝的质量分数
难度: 中等查看答案及解析