-
在实验室欲加速制取氢气,最好的方法是采用( )。
A.纯锌跟稀硫酸溶液 B.纯锌+稀盐酸
C.粗锌(含少量铜)跟稀硫酸溶液 D.粗锌(含少量铜)跟醋酸溶液
难度: 中等查看答案及解析
-
可确认发生了化学平衡移动的是( )
A.化学反应速率发生了改变
B.有气态物质参加的可逆反应达到平衡后,改变了压强
C.由于某一条件的改变,使平衡混合物中各组分的浓度发生了不同程度的改变
D.可逆反应达到平衡后,使用催化剂
难度: 中等查看答案及解析
-
用标准的盐酸滴定未知浓度的NaOH溶液时,下列各操作中,无误差的是( )
A.用蒸馏水洗净酸式滴定管后,注入标准溶液盐酸进行滴定
B.用蒸馏水洗涤锥形瓶后再用NaOH溶液润洗,而后装入一定体积的NaOH溶液进行滴定
C.用碱式滴定管量取10.00mLNaOH溶液放入用蒸馏水洗涤后的锥形瓶中,再加入适量蒸馏水和2滴甲基橙试液后进行滴定
D.若改用移液管取待测液10.00mLNaOH溶液放入锥形瓶后,把留在移液管尖嘴处的液体吹入锥形瓶内,再加入1mL甲基橙指示剂后进行滴定
难度: 中等查看答案及解析
-
下列说法正确的是
A.每一周期元素都是从碱金属开始,以稀有气体结束
B.f区都是副族元素,s区和p区的都是主族元素
C.已知在200C 1mol Na失去1 mol电子需吸收650kJ能量,则其第一电离能为650KJ/mol。
D.Ge的电负性为1.8,则其是典型的非金属
难度: 中等查看答案及解析
-
实验测得 BeCl2为共价化合物,两个Be—Cl键间的夹角为180°.由此可见,BeCl2属于
A.由极性键构成的极性分子
B.由极性键构成的非极性分子
C.由非极性键构成的极性分子
D.由非极性键构成的非极性分子
难度: 中等查看答案及解析
-
主族元素A原子的结构示意图为
。则X、Y及该原子3p能级上的电子数分别为 ( )
A.18、6、4 B.20、8、6
C.18、8、6 D.15~20、3~8、1~6
难度: 中等查看答案及解析
-
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为 ( )
A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。
C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。
D.氨气分子是极性分子而甲烷是非极性分子。
难度: 中等查看答案及解析
-
关于氢键,下列说法正确的是 ( )
A.每一个水分子内含有两个氢键
B.冰、水和水蒸气中都存在氢键
C.DNA中的碱基互补配对是通过氢键来实现的
D.H2O是一种非常稳定的化合物,这是由于氢键所致
难度: 中等查看答案及解析
-
反应aX(g) + bY(g)
cZ(g);△H=Q,有下图所示关系,下列判断中正确是( )
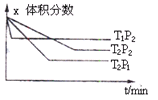
A.a+b < c, Q > 0 B.a+b < c, Q < 0
C.a+b > c, Q > 0 D.a+b > c, Q < 0
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A.原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质相似
B.Fe3+的最外层电子排布式为:3s23p63d5
C.硫离子的结构示意图为:
D.基态碳原子的电子排布图:
难度: 中等查看答案及解析
-
工业上由二氧化锰制备高锰酸钾可分二步进行,第一步二氧化锰与氢氧化钾共熔并通入氧气2MnO2 + 4KOH +O2
2K2MnO4 +2H2O;第二步:电解锰酸钾溶液:
2K2MnO4 +H2O
2KMnO4 +H2↑ +2 KOH 下列说法叙述正确的是
A.氧化性:KMnO4>K2MnO4 >O2
B.根据上述过程,每生成1molKMnO4共转移6mol电子
C.第二步电解时阴极周围pH减小
D.第二步电解时,KMnO4在阳极区生成
难度: 简单查看答案及解析
-
一定条件下存在下列平衡: 2A(g)
B(g); △H < O在测定A的相对分子质量时,下列条件中测定结果误差最小的是( )
A.温度150℃、压强5.05×104 Pa B.温度150℃、压强4.04×105 Pa
C.温度25℃、压强1.0 1 × 105 Pa D.温度0℃、压强5.05×104 Pa
难度: 中等查看答案及解析
-
镍--镉(Ni--Cd)可充电电池可以发生如下反应:
Cd(OH)2 + 2Ni(OH)2
Cd + 2NiO(OH)+ 2H2O
由此可知,该电池充电时的阳极是( )。
A.Cd B.NiO(OH) C.Cd(OH)2 D.Ni(OH)2
难度: 简单查看答案及解析
-
如图所示烧杯中均盛有海水,铁在其中被腐蚀时由快到慢的顺序是( )。
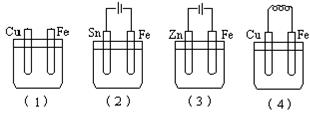
A.(2)(4)(1)(3) B.(3)(4)(1)(2) C.(4)(3)(2)(1) D.(1)(3)(2)(4)
难度: 简单查看答案及解析
-
某温度下,0.1mol·L-1NaHCO3溶液pH=10,下列判断正确的是( )
A.溶液中碳酸氢根电离的氢离子浓度为10-10mol·L-1
B.
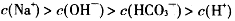
C.溶液中水电离的氢氧根离子浓度为10-4mol·L-1
D.
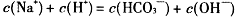
难度: 简单查看答案及解析
-
下列对溶液叙述正确的是
A.向冰醋酸中加水至配成醋酸稀溶液的过程中H+的浓度逐渐减小
B.对于物质的量浓度相同的氢氧化钠和氨水,加水稀释至m倍、n倍后,若稀释后溶液的PH相等,则m<n
C.常温下,5ml0.02mol/LHCl溶液与5ml0.02mol/LBa(OH)2溶液混合,经充分反应后,如果溶液体积为10mL,则溶液的PH=12
D.常温下将稀NaOH溶液与醋酸溶液混合,可能出现PH>7的情况,且c(OH-)>c(Na+)>c(CH3COO-)>c(H+)
难度: 困难查看答案及解析
