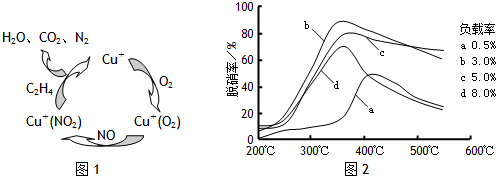
-
下列说法不正确的是( )
A.2008年北京奥运会开幕式上的“脚印”等焰火让全世界为之欢呼、倾倒,这主要是利用了化学中“焰色反应”的知识
B.我国神七宇航员所穿航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料
C.中国第1艘LNG船“大鹏昊”已于2009年5月2日满载65000吨LNG,抵达广东.船底镶嵌锌块,锌作正极,以防船体被腐蚀
D.低碳生活就是节能减排,使用太阳能等代替化石燃燃料,可减少温室气体的排放难度: 中等查看答案及解析
-
瑞典皇家科学院10月6日宣布三位科学家共同获得2010年诺贝尔化学奖.20世纪60年代末至70年代初,美国科学家理查德•赫克利用烯烃的有机小分子在钯作用下合成大分子.1977年,日本科学家根岸英一用锌原子将碳原子运送到钯原子上,实现“根岸反应”.两年后,日本科学家铃木章用硼元素取代锌,实现类似的效果,并且毒性更低,适宜规模化生产,这就是“铃木反应”.对以上涉及的元素及化合物说法不正确的是( )
A.碳是短周期元素
B.硼酸是弱酸
C.钯及化合物常作催化剂
D.锌是主族元素难度: 中等查看答案及解析
-
下列有关物质结构的表述正确的是( )
A.硫能形成分子晶体
B.二氧化硅的分子式SiO2
C.次氯酸的电子式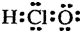
D.钠离子的结构示意图难度: 中等查看答案及解析
-
下列各组离子能在指定溶液中大量共存的是( )
①无色溶液中:Al3+,Cl-,Na+,HCO3-,SO42-
②使pH=11的溶液中:Na+,AlO2-,NO3-,S2-,SO32-
③加入Mg能放出H2的溶液中:Mg2+,NH4+,Cl-,K+,SO42-
④使pH试纸呈红色的溶液中:Fe3+,MnO4-,Na+,SO42-
⑤酸性溶液中:Fe2+,Al3+,NO3-,I-.
A.①②④
B.①⑤
C.②③④
D.①②③难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是( )
A.将氯气溶于水制备次氯酸:Cl2+H2O⇌2H++Cl-+ClO-
B.碳酸氢钙与过量的NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
C.NaOH溶液中通入少量二氧化硫:SO2+0Hˉ=HSO3-
D.稀硝酸与过量的铁屑反应 3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O难度: 中等查看答案及解析
-
设NA为阿佛加德罗常数,下列叙述不正确的( )
A.5g质量分数为46%的乙醇溶液中,氢原子的总数为0.6NA
B.5.6 g铁与0.1 mol氯气充分反应转移电子数为 0.2NA
C.50 mL 12 mol•L-1 浓盐酸与足量二氧化锰加热反应,转移电子数为0.3 NA
D.常温常压下,46g NO2与N2O4的混合气体中含有的原子总数为3NA难度: 中等查看答案及解析
-
某溶液中含有NO3-、SiO32-、AlO2-、S2-等4种离子,若向其中加入过量的盐酸溶液,微热并搅拌,再加入过量的氢氧化钠溶液,则溶液中离子数目大量减少的是( )
A.只有S2-
B.S2-和NO3-
C.SiO32-、S2-和NO3-
D.四种离子都减少难度: 中等查看答案及解析
-
同位素示踪法可用于反应机理的研究,下列有关反应中同位素示踪表示正确的是( )
A.2Na218O2+2H2O→4Na18OH+O2↑
B.2KMnO4+5H218O2+3H2SO4→K2SO4+2MnSO4+518O2↑+8H2O
C.NH4Cl+2H2O⇌NH3•2H2O+HCl
D.K37ClO3+6HCl→K37Cl+3Cl2↑+3H2O难度: 中等查看答案及解析
-
右图是反应CO(g)+2H2(g)═CH3OH(g)进行过程中的能量变化曲线.下列相关说法正确的是( )
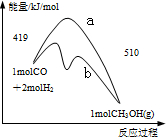
A.该反应是吸热反应
B.使用催化剂后反应热减小
C.热化学方程式为CO(g)+2H2(g)═CH3OH(g)△H=-510 kJ•mol-1
D.曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化难度: 中等查看答案及解析
-
下列判断错误的是( )
A.分别用H2O2、KMnO4分解制O2,当制得等质量O2时,转移电子数之比为1:2
B.CO(g)的标准燃烧热是283.0 kJ•mol-1,则2CO2(g)═2CO(g)+O2(g)反应的△H=-566 kJ•mol-1
C.同温同压下,密度相同的两种气体的摩尔质量相同
D.20mL 0.1mol•L-1NaCl与10mL0.2mol•L-1BaCl2溶液中Cl-物质的量浓度比为1:4难度: 中等查看答案及解析
-
短周期元素A、B、C的原子序数依次递增,三者原子最外层电子数之和为14,A原子的次外层电子数等于B原子的最外层电子数,A与C同主族.则下列叙述正确的是( )
A.原子半径:A<B<C
B.氢化物稳定性:A<C
C.B与A的化合物比A与C的化合物熔点低
D.C最高价氧化物对应的水化物是一种强酸难度: 中等查看答案及解析
-
下列说法正确的是( )
A.铅蓄电池放电时铅电极发生还原反应
B.电解饱和食盐水在阳极得到氯气,阴极得到金属钠
C.给铁钉镀铜可采用CuSO4作电镀液
D.生铁浸泡在食盐水中发生析氢腐蚀难度: 中等查看答案及解析
-
下列制备和收集气体的实验装置合理的是( )
A.
用氯化铵和氢氧化钙制NH3
B.
用铜片和稀硝酸制NO
C.
用锌粒和稀硫酸制H2
D.
用双氧水和二氧化锰制O2难度: 中等查看答案及解析
-
下表各组物质之间通过一步反应不可以实现如图所示转化关系的是 ( )
选项 X Y Z 箭头上所标数字的反应条件 A Fe FeCl2 FeCl3 ④加入铁粉 B AlCl3 NaAlO2 Al(OH)3 ②通入CO2 C CaO Ca(OH)2 CaCO3 ①常温遇水 D Cl2 Ca(ClO)2 HClO ③加浓盐酸 
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g/cm3,溶质的质量分数为ω,溶质的物质的量浓度为c mol/L.下列叙述中正确的是( )
A.ω=×100%
B.c=mol/L
C.上述氨水中再加入等体积等浓度的稀盐酸后溶液恰好呈中性
D.上述氨水中再加入V mL水后,所得溶液的质量分数小于0.5ω难度: 中等查看答案及解析
-
向含有0.2mol氢氧化钠和0.1mol氢氧化钙的溶液中,持续稳定地通入二氧化碳气体,通入气体为6.72L(标准状况)时,立即停止,则这一过程中,溶液中离子数目与通入二氧化碳气体体积的关系正确的是(不考虑气体的溶解)( )
A.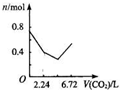
B.
C.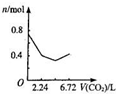
D.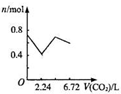
难度: 中等查看答案及解析