-
化学与生活、社会密切相关,下列说法错误的是
A.过氧化钠可作航天员和潜水员的供氧剂
B.干冰和碘化银均可用于人工降雨
C.近年来出现的城市雾霾与汽车尾气的排放无关
D.高铁车厢大部分材料采用铝合金,因为铝合金强度大、质量轻、抗腐蚀能力强
难度: 简单查看答案及解析
-
下列关于物质分类的说法正确的是
A.Na2O2﹑CaO﹑K2O都是碱性氧化物 B.BaSO4﹑NaCl﹑KNO3溶液都是电解质
C.纯碱﹑烧碱﹑碱石灰都是碱 D.稀豆浆﹑果冻﹑淀粉溶液都是胶体
难度: 简单查看答案及解析
-
下列离子反应方程式错误的是
A.向Na2SiO3溶液中逐滴加入少量稀盐酸:SiO32-+ 2H+=H2SiO3(胶体)
B.向Na2S2O3溶液中加入稀硫酸:2S2O32-+2H+=SO42-+3S↓+H2O
C.将Cu片加入稀硝酸中:3Cu + 8H++2NO3-=3Cu2+ +2NO↑+ 4H2O
D.向NH4Al(SO4)2溶液中加入过量的Ba(OH)2稀溶液:NH4+ + Al3+ + 2SO42- + 2Ba2+ + 5OH-=2BaSO4↓+ NH3·H2O + AlO2-+ 2H2O
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.12g金刚石晶体中含有的C—C的数目为2NA
B.1L 1 mol·L-1 AlCl3溶液中含有的Al3+数目为NA
C.在标况下,11.2L氯气通入足量的NaOH溶液中转移电子数为NA
D.常温常压下,22g CO2气体中含有的σ键和π键的数目均为2NA
难度: 中等查看答案及解析
-
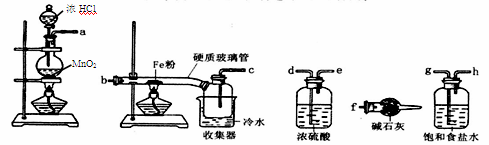
有关下列实验操作的说法正确的是
A.实验室可用pH试纸测量浓硫酸的pH值
B.做焰色反应实验时,直接取用铂丝蘸取物质在酒精灯外焰上灼烧,观察其颜色
C.用碱式滴定管移取20.00mL高锰酸钾溶液
D.用四氯化碳萃取碘水中I2的过程中,将分液漏斗倒转过来振荡,使两种液体充分接触;振荡后打开活塞,使漏斗内的气体放出
难度: 简单查看答案及解析
-
下列溶液或浊液中,关于离子浓度的说法正确的是
A.一定浓度的氨水加水稀释的过程中,c(NH4+)/ c(NH3·H2O)的比值减小
B.浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液中:c(CO32-) > c(HCO3-),且2c(Na+)=3[c(CO32-)+c(HCO3-)]
C.0.2 mol·L-1的醋酸(CH3COOH)溶液与0.1 mol·L-1 NaOH溶液等体积混合后:c(CH3COO-) + 2c(OH-) = c(CH3COOH) + 2c(H+)
D.常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4悬浊液中的c(Ag+)一定小于AgCl悬浊液中的c(Ag+)
难度: 困难查看答案及解析
-
亚硝酸钠(NaNO2)是一种具有咸味、有毒,且价格比食盐(NaCl)便宜的工业用盐,常被误作食盐使用,导致多起中毒事故发生。它的部分性质见下图,

下列说法错误的是
A.上图所涉及到的化学反应都是氧化还原反应
B.N2H4极易溶于水,因为它是极性分子且与水分子之间易形成氢键
C.NaNO2与N2H4生成NaN3的反应方程式为:NaNO2 + N2H4 = NaN3 + 2H2O
D.可用淀粉碘化钾试纸和食醋鉴别食盐(NaCl)与亚硝酸钠(NaNO2)
难度: 中等查看答案及解析