-
已知有如下反应:①2Fe3++2I-═2Fe2++I2 ②2Fe2++Br2═2Fe3++2Br-③2Fe(CN)64-+I2═2Fe(CN)63-+2I-,试判断氧化性强弱顺序正确的是( )
A.Fe3+>Br2>I2>Fe(CN)63-
B.Br2>I2>Fe3+>Fe(CN)63-
C.Br2>Fe3+>I2>Fe(CN)63-
D.Fe(CN)63->Fe3+>Br2>I2难度: 中等查看答案及解析
-
一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3=2HNO3+4N2↑+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
A.5:3
B.5:4
C.1:1
D.3:5难度: 中等查看答案及解析
-
如果花生油中混有水,最好采用下列何种方法分离( )
A.过滤
B.蒸馏
C.分液
D.萃取难度: 中等查看答案及解析
-
在碱性溶液中能大量共存且溶液为无色透明的离子组是( )
A.K+、MnO4-、Na+、Cl-
B.K+、Na+、NO3-、CO32-
C.Na+、H+、NO3-、SO42-
D.Cu2+、Na+、Cl-、SO42-难度: 中等查看答案及解析
-
下列溶液中Cl-浓度与50mL 1mol•L-1 AlCl3溶液中Cl-浓度相等的是( )
A.150mL 1mol•L-1的NaCl溶液
B.75mL 2mol•L-1NH4Cl溶液
C.150mL 2mol•L-1的KCl溶液
D.75mL 1mol•L-1的FeCl3溶液难度: 中等查看答案及解析
-
实验室里需用480mL 0.1mol•L-1的硫酸铜溶液,现选取500mL容量瓶进行配制,以下操作正确的是( )
A.称取7.68g硫酸铜,加入500mL水
B.称取12.0g胆矾配成500mL溶液
C.称取8.0g硫酸铜,加入500mL水
D.称取12.5g胆矾配成500mL溶液难度: 中等查看答案及解析
-
下面是有关厨房中的常见操作或者常见现象,其中不涉及氧化还原反应的是( )
A.烧菜用过的铁锅,经放置常出现红棕色斑迹
B.用煤气灶燃烧天然气为炒菜提供热量
C.铜质炊具长久不用生铜绿
D.灶具大理石板被食醋腐蚀变得不光滑难度: 中等查看答案及解析
-
下列状态的物质,既能导电又属于电解质的是( )
A.NaCl溶液
B.液态HCl
C.熔融的KOH
D.蔗糖溶液难度: 中等查看答案及解析
-
FeCl3溶液与Fe(OH)3胶体具有共同的性质是( )
①分散质颗粒直径在1-100nm之间 ②能通过滤纸 ③都是透明的 ④呈红褐色.
A.①②
B.②③
C.③④
D.②④难度: 中等查看答案及解析
-
实验是化学研究的基础,关于下列各实验装置图的叙述中,错误的是( )
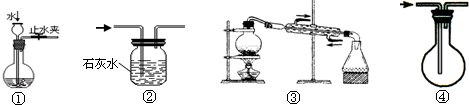
A.装置①可用于检查装置的气密性
B.装置②可用于除去CO中混有的少量CO2
C.装置③可用于从海水中得到淡水
D.装置④可用于排空气收集CO难度: 中等查看答案及解析
-
下表是某加碘盐包装袋上的部分文字说明.
根据这一说明某学生作出如下判断,其中正确的是( )配料 氯化钠(NaCl)、碘酸钾(KIO3) 含碘量 (35±15)mg•kg-1(以I计) 食用方法 菜未烧熟不宜加入加碘盐,菜烧熟后加入加碘盐最佳.
A.此食盐是纯净物
B.“加碘食盐”中的“碘”是指碘单质
C.1kg此食盐中含碘酸钾(35±15)mg
D.“菜未烧熟不宜加入加碘盐”的原因可能是碘酸钾受热不稳定难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.标准状况下,22.4L水中所含的分子数约为6.02×1023
B.1.00molNaCl中,所有Na+的最外层电子总数为8×6.02×1023
C.欲配置1.00L,1.00mol.L-1的NaCl溶液,可将58.5gNaCl溶于1.00L水中
D.22g二氧化碳与标准状况下11.2L氯化氢气体含有的分子数不同难度: 中等查看答案及解析
-
下列化学反应的离子方程式正确的是( )
A.用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O
B.往碳酸镁中滴加稀盐酸:CO32-+2H+═CO2↑+H2O
C.二氧化碳通入足量的氢氧化钠溶液:CO2+OH-═HCO3-
D.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O难度: 中等查看答案及解析
-
有两种金属组成的混合物粉末10g与足量的稀盐酸反应,生成11.2L(标况)H2,则该混合物的组成不可能是( )
A.Fe、Zn
B.Al、Cu
C.Al、Mg
D.Al、Fe难度: 中等查看答案及解析
-
有BaCl2和NaCl的混合溶液aL,将它均分成两份.一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀.反应中消耗xmol H2SO4、ymol AgNO3.据此得知原混合溶液中的c(Na+)/mol•L-1为( )
A.
B.
C.
D.难度: 中等查看答案及解析
-
在一定条件下,
和氟气可发生如下反应:
═
从而可知在
中,元素R的化合价是( )
A.+4
B.+5
C.+6
D.+7难度: 中等查看答案及解析