-
利用核聚变发电,3He是最安全、最清洁的能源.地球上3He仅有15吨左右,月球上的3He最保守估计可供全世界开采500年.地球上的氦元素主要以4He形式存在,而月球土壤中吸附着数百万吨3He.下列说法正确的是①3He、4He的化学性质基本相同;②3He、4He具有相同的中子数;③3He核聚变是化学变化;④3He液化是物理变化;⑤3He和4He形成的晶体类型相同,所含化学键不同;⑥3He和4He组成的气体单质,在相同条件下密度之比为3:4.( )
A.①②⑤
B.①④⑥
C.②③⑤
D.③④⑥难度: 中等查看答案及解析
-
下列化学用语表达正确的是( )
A.HClO的电子式
B.Fe2+的离子结构示意图: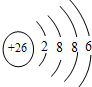
C.光气COCl2的结构式:
D.sp2杂化轨道模型:难度: 中等查看答案及解析
-
珠江三角洲曾遭遇“咸潮”,水源中含氯量高达7100mg/L,远远超过正常值250mg/L.下列有关说法正确的是( )
A.“咸潮”中氯离子浓度可达0.2mol•L-1
B.自来水厂可加入适量AgNO3溶液除去Cl-
C.自来水厂可用蒸馏法来净化水
D.直接用“咸潮”水作为水源,对人体无害难度: 中等查看答案及解析
-
下列实验操作正确的是( )
A.中和滴定实验时,锥形瓶用蒸馏水洗净,烘干后才能使用
B.中和热的测定实验中,读取混合溶液的最高温度为终止温度
C.实验室制取氯气的实验中,为防止污染空气,用饱和食盐水吸收尾气
D.验证蔗糖水解产物时,在蔗糖溶液中加稀硫酸加热水解,再加入银氨溶液并加热难度: 中等查看答案及解析
-
下列各种试剂中:①浓溴水 ②食盐溶液 ③浓H2SO4 ④Na2SO3溶液 ⑤石灰水 ⑥氢硫酸 ⑦NaClO溶液,长期放置在空气中不容易变质而浓度变小的组合是( )
A.①③④
B.④⑤⑥
C.②④⑦
D.只有①③难度: 中等查看答案及解析
-
下列关于化学基本原理和基本概念的几点认识中正确的是( )
A.胶体区别于其他分散系的本质特征是丁达尔现象
B.一般认为沉淀离子浓度小于1.0×10-5mol/L时,则认为已经沉淀完全
C.由于Ksp(BaSO4)小于Ksp(BaCO3),因此不可能使生成的BaSO4沉淀再转化为BaCO3沉淀
D.由SO2通入Ba(NO3)2溶液产生白色沉淀可知,BaSO3不溶于硝酸难度: 中等查看答案及解析
-
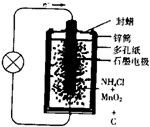
金属氢化物可以作为航空航天的燃料电池的新型燃料.供氢效率指单位质量金属氢化物提供氢气的量.下列四种金属氢化物供氢效率最高的是( )
A.LiH
B.NaH
C.MgH2
D.KH难度: 中等查看答案及解析
-
下列实验过程中产生的现象与对应图形相符合的是( )
A.
盐酸中加入NaAlO2溶液
B.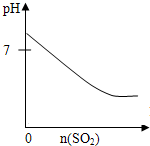
SO2气体通入溴水中
C.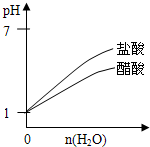
pH═1的醋酸和盐酸分别加水稀释
D.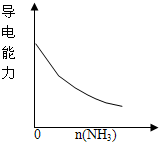
氨气通入醋酸溶液中难度: 中等查看答案及解析
-
2008年初,南方经历了50年一遇的大雪灾,导致交通中断,电网大面积瘫痪.为了打通京珠高速,有关部门在京珠高速上撒下了数千吨融雪剂帮助破冰除雪,恢复交通.融雪剂主要分为两大类,一类是以醋酸钾为主要成分的有机融雪剂,虽然这一类融雪剂融雪效果好,没有什么腐蚀损害,但它的价格太高,一般只适用于机场等地.而另一类则是氯盐类融雪剂,包括氯化钠、氯化钙、氯化镁、氯化钾等,通称作“化冰盐”.它的优点是便宜,价格仅相当于有机类融雪剂的1/10,但它对大型公共基础设施的腐蚀是很严重的.下列说法中不正确的是( )
A.通过在熔融状态下能否导电来证明CaCl2是否为离子化合物
B.CaCl2通常用作干燥剂,但是不能干燥NH3
C.电化学腐蚀是造成钢铁腐蚀的主要原因
D.“化冰盐“可以替代食盐来作调味剂,氯盐类融雪剂不会造成地下水污染难度: 中等查看答案及解析
-
向含大量Na+、Cl-的溶液中通入足量的NH3后,该溶液中还可能大量存在的离子组是( )
A.K+、Br-、CO32-
B.Al3+、H+、MnO4-
C.NH4+、Ba2+、NO3-
D.Ag+、Cu2+、SO42-难度: 中等查看答案及解析
-
25℃时,将pH=x的H2SO4溶液与pH=y的NaOH溶液按体积比1:100混合,反应后所得溶液pH=7.若x=
y,则x为( )
A.2
B.4
C.3
D.5难度: 中等查看答案及解析
-
有下列四种有机物对此四种有机物的有关说法正确的是( )

A.四种有机物都是芳香族化合物
B.四种有机物都能发生水解
C.四种有机物中,环上一氯代物布洛芬的种类最多
D.等物质的量的四种有机物与NaOH溶液反应,阿司匹林消耗NaOH物质的量最多难度: 中等查看答案及解析
-
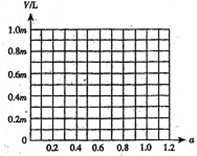
在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g•cm-3,溶质的质量分数为ω,溶质的物质的量浓度为C mol/L.下列叙述中正确的是( )
A.ω=
B.C=
C.上述溶液中再加入1.5VmL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D.上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω难度: 中等查看答案及解析
-
已知可逆反应:A(s)+2B(g)⇌C(g)+D(g)△H<0.在一定温度下将1mol A和2molB加入如图所示甲容器中,将2molC和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,在恒温下使两容器内反应均达到平衡状态(如图所示,隔板K不能移动).下列说法正确的是( )
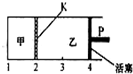
A.保持温度和活塞位置不变,甲中再加入1 mol A和2mol B,达到新的平衡后,c(B)甲=2c(B)乙
B.保持温度和乙中压强不变,向乙中再加入2 mol D,达到新平衡后,c(B)乙>c(B)甲
C.若该温度下反应的K=1,则甲中B和乙中C的转化率均为66.7%
D.保持乙中压强不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增大难度: 中等查看答案及解析

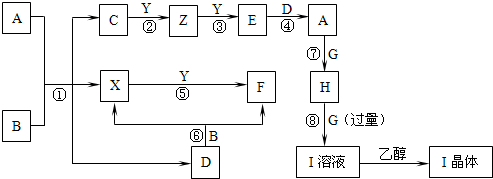
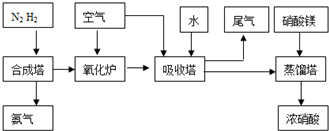
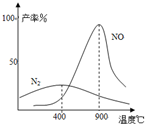
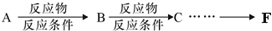 ________.
________.