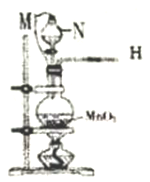
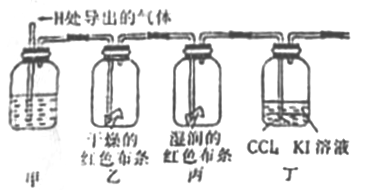
-
判断下列有关化学基本概念或名词的依据正确的是( )
A. 共价化合物:是否含有共价键
B. 纯净物与混合物:是否仅含有一种元素
C. 电解质与非电解质:物质本身是否具有导电性
D. 溶液与胶体:本质在于分散质粒子直径的大小
难度: 中等查看答案及解析
-
下列实验现象与新制氯水中的某些成分(括号内物质)没有关系的是( )
A. 将NaHCO3固体加入新制氯水中,有无色气泡(H+)
B. 新制氯水呈黄绿色(Cl2)
C. 使蓝色石蕊试纸先变红后褪色(H+、Cl2)
D. 滴加AgNO3溶液生成白色沉淀(Cl-)
难度: 中等查看答案及解析
-
N2和O2在一定条件下发生化合反应生成气体B,反应掉O2体积是反应掉N2的体积的1.5倍(同温同压),则B分子的组成是( )
A. N2O B. N2O3 C. NO2 D. N2O4
难度: 困难查看答案及解析
-
能与Al反应生成H2的透明溶液中可能大量共存的一组离子是( )
A. K+、NO3-、AlO2-、Na+ B. NH4+、SO42-、CO32-、NO3-
C. Mg2+、Fe3+、Cl-、SCN- D. K+、Ca2+、Cl-、HCO3-
难度: 中等查看答案及解析
-
将100gNa2CO3和NaHCO3的混合物用酒精灯加热至质量不再变化时,固体质量减少到75.2g。此混合物中Na2CO3的质量分数是( )
A. 75.2% B. 67.2% C. 41.7% D. 32.8%
难度: 困难查看答案及解析
-
NA是阿伏加德罗常数的值,下列叙述正确的是( )
A. 标准状况下,11.2 LCH3CH2OH中含有分子的数目为0.5NA
B. 58.5gNaCl晶体中含有NA个NaCl分子
C. 56g铁粉与一定量氯化铁溶液反应生成0.75molFeCl2,失去的电子数为0.5 NA
D. 100mL浓度均为0.2mol/L的MgCl2和AlCl3混合溶液中阴离子的数目为0.05NA
难度: 中等查看答案及解析
-
下列有关物质制备的说法中正确的是( )
A. 将饱和FeCl3溶液滴入到NaOH溶液中加热煮沸可制得Fe(OH)3胶体
B. 可用Na从TiCl4的水溶液中生产Ti
C. 工业上利用氯气和石灰水反应生产漂白粉和漂粉精
D. 可用石英、石灰石、纯碱在高温下生产玻璃
难度: 中等查看答案及解析
-
下列实验操作或装置正确的是( )
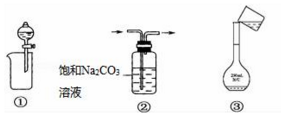
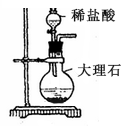
A. ①分离出BaSO4浊液中的BaSO4 B. ②除去CO2中少量HCl气体
C. ③配制一定物质的量浓度溶液时转移溶液 D. ④制取一定量的CO2
难度: 中等查看答案及解析
-
误食NaNO2会导致血红蛋白中的Fe2+氧化为Fe3+而中毒,服用维生素C可以解除NaNO2引起的中毒。下列关于上述中毒、解毒过程的说法中正确的是( )
A. NaNO2是还原剂
B. 维生素C的还原性强于Fe2+
C. 1×10-3molFe2+被NaNO2氧化为Fe3+时得到1×10-3mol电子
D. 解毒过程中维生素C被还原
难度: 中等查看答案及解析
-
下列化合物中,可以通过置换反应一步得到的是( )
①FeSO4 ②NaOH ③Fe3O4 ④Al2O3
A. ①②③④ B. ①②③ C. ①④ D. ①③
难度: 中等查看答案及解析
-
下列选项中,符合右图所示关系的是( )
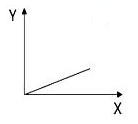
A. 一定状况下,气体摩尔体积(Y)与该气体的物质的量(X)的关系
B. 在光照情况下,一定体积的饱和氯水的pH(Y)随时间(X)的关系
C. 100℃,1个大气压下,按体积比1∶1混合的CO2和H2O(g)混合气通过足量Na2O2粉末,固体增加的质量(Y)与混合气体积(X)的关系
D. 向AlCl3溶液中滴加NaOH溶液至过量,生成Al(OH)3 的物质的量(Y)与消耗NaOH的物质的量(X)的关系
难度: 困难查看答案及解析
-
烧杯中盛有含Mg2+、Al3+、Fe3+、Na+、Fe2+、Cl-六种离子的溶液,若向其中加入足量的Na2O2搅拌,充分反应后再向该烧杯中滴加足量的稀盐酸,此时上述离子物质的量保持不变的有( )
A. 1 种 B. 2 种 C. 3 种 D. 4种
难度: 困难查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A. 氯气溶于水:Cl2+H2O=Cl-+ClO-+2H+
B. 金属钠加入稀硫酸中:Na +2H+=Na++ H2↑
C. 明矾溶液中加入足量Ba(OH)2溶液:SO42-+Al3++Ba2++4OH-=AlO2-+BaSO4↓+2H2O
D. 向含有稀盐酸的氯化亚铁溶液中通入氧气:4Fe2++O2+4H+═4 Fe3++2H2O
难度: 中等查看答案及解析
-
在实验室进行下列实验,括号内的实验仪器或试剂都能用得上的是( )
A. 配制100g20%的氢氧化钠溶液(烧杯、100mL容量瓶、胶头滴管)
B. 钠的焰色反应(铂丝、硫酸钠溶液、稀盐酸)
C. 从碘水中提取碘(蒸发皿、酒精灯、玻璃棒)
D. 除去自来水中的Cl-(铁架台、玻璃棒、漏斗)
难度: 中等查看答案及解析
-
下列叙述Ⅰ和Ⅱ均正确并有因果关系的是( )
选项
叙述Ⅰ
叙述Ⅱ
A
Si有导电性
Si可用于制备光导纤维
B
Fe的金属活动性大于Cu
FeCl3溶液可用于回收废旧电路板中的铜
C
Na2O2与水反应能生成碱
Na2O2属于碱性氧化物
D
次氯酸光照易分解
新制氯水保存在棕色试剂瓶中,放于冷暗处
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
Al可以与稀硝酸反应,已知HNO3被还原为N2O。若标准状况有3.36LN2O生成。则参加反应的铝的质量(g)为( )
A. 27 B. 5.4 C. 10.8 D. 16.2
难度: 困难查看答案及解析
-
一定条件下,24mL的CO2和N2的混合气体通过足量的过氧化钠粉末,充分反应后得到相同状况下的气体20ml,则原混合气体中CO2的体积分数为( )
A. 33.3% B. 44% C. 56% D. 66.7%
难度: 中等查看答案及解析
-
取10g粗铁加入足量稀硫酸中,共收集到5.6L氢气(标准状况),则粗铁中混有的杂质不可能是( )
A. Cu和Mg B. Mg和Al C. Al 和 Si D. SiO2和Zn
难度: 中等查看答案及解析
-
化学反应3Fe2++2S2O32-+O2+aOH-=Fe3O4+S4O62-+2H2O是水热法制备Fe3O4纳米颗粒的原理。下列说法正确的是( )
A. 参加反应的Fe2+全部作还原剂
B. 生成1.5molFe3O4时,反应转移电子 6mol电子
C. 方程式中a=2
D. 反应中被氧化的元素是Fe,被还原的元素是S和O
难度: 中等查看答案及解析
-
甲、乙两种溶液中分别含有大量的Cu2+、K+、H+、Cl-、CO32-、OH-这6种离子中的3种(两种溶液中的离子不重复),已知乙溶液为无色溶液,则甲溶液中大量存在的离子是( )
A. Cu2+、H+、Cl- B. K+、OH- 、CO32- C. CO32-、OH-、Cl- D. K+、H+、Cl-
难度: 中等查看答案及解析
-
利用硫酸钾、硫酸镁、硫酸铝三种溶液分别与相同体积、相同浓度的氯化钡溶液反应使Ba2+恰好完全沉淀,需要三种溶液的体积比为3∶2∶2,则三种溶液的溶质的物质的量浓度之比为( )
A. 3∶4∶2 B. 2∶3∶3 C. 6∶3∶1 D. 2∶3∶1
难度: 中等查看答案及解析