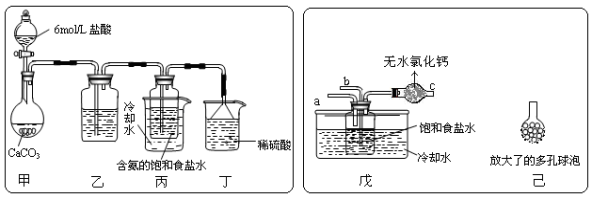
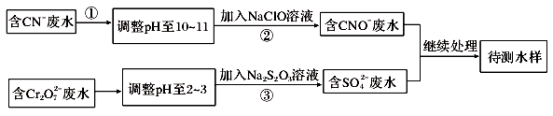
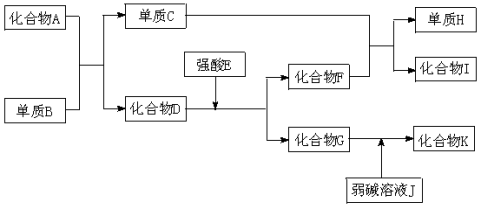
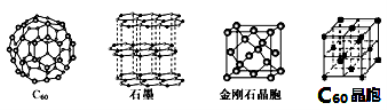
-
生活中的一些问题常涉及到化学知识,则下列叙述正确的是
A.高温能杀死流感病毒是因为构成病毒的蛋白质受热变性
B.明矾和漂白粉常用于自来水的处理,两者的作用原理相同
C.氯化铁溶液可用于制作印刷电路板是因为其具有较强氧化性,与铜发生置换反应
D.晶体硅具有半导体的性质,所以可以制作光导纤维
难度: 中等查看答案及解析
-
下列说法中正确的是
A.由Na2CO3 + SiO2
Na2SiO3 + CO2↑可知,酸性H2SiO3>H2CO3
B.氢氟酸需要密封存放在橡胶塞的玻璃试剂瓶中
C.向硅酸钠溶液中加入盐酸产生白色沉淀,过量时沉淀溶解
D.瓷坩埚、氧化铝坩埚均不可作为融化NaOH固体的装置
难度: 中等查看答案及解析
-
把任意比的NaHCO3和Na2O2的混合物放在密闭容器中加热,关于混合物加热前后与足量盐酸反应消耗盐酸的量,下列判断正确的是
A.加热前后一样多 B.加热前消耗的多
C.加热后消耗的多 D.当Na2O2适量时才会一样多
难度: 中等查看答案及解析
-
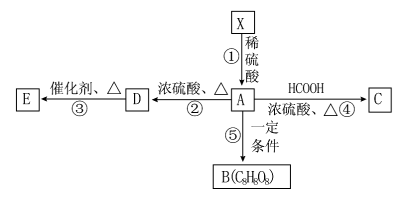
某溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是
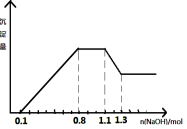
A.溶液中的阳离子只有H+、Mg2+、Al3+可能含有Fe3+
B.溶液中一定不含CO32-和NO3-,一定含有SO42-
C.溶液中c(NH4+)=0.3 mol/L
D.c(H+)∶c (Al3+)∶c(Mg2+)=1∶1∶1
难度: 困难查看答案及解析
-
下列叙述中,正确的是
A.依据铝热反应原理,能发生反应2Al+3MgO
3Mg+Al2O3
B.在加入铝粉能放出氢气的溶液中:K+、NH4+、CH3COO-、Cl-一定能够大量共存
C.铁片放入过量的稀硝酸中:3Fe+8H++2NO3-===3Fe2++2NO↑+4H2O
D.氯化铝溶液中加入过量氨水反应实质是Al3++3NH3·H2O===Al(OH)3↓+3NH4+
难度: 困难查看答案及解析
-
下列几组标签被腐蚀的试剂①Al2(SO4)3溶液、KOH溶液②NaAlO2溶液 、H2SO4溶液③NaHCO3溶液、 HCl溶液④AgNO3 、氨水⑤CuSO4溶液、NaOH溶液⑥CCl4、NaCl溶液,不用其他试剂,只用胶头滴管和试管就可以鉴别的是
A .①②③④ B.①②④⑤⑥ C.①②③④⑤ D.全部
难度: 中等查看答案及解析
-
现有Fe2O3和Fe3O4组成的混合物W g,将其投入到V mL5mol/L的盐酸中,再加入22.4g铁粉,固体恰好完全溶解,收集到标准状况下气体4480mL。向反应后溶液中滴加KSCN溶液,无颜色变化,下列推断正确的是
A.转移电子为1.0mol B.W可能等于48.8
C.V可能等于360 D.发生的反应均为氧化还原反应
难度: 中等查看答案及解析