-
下列说法错误的是
A.热化学方程式各物质前的化学计量数不表示分子个数,只代表物质的量
B.热化学方程式未注明温度和压强时,ΔH表示标准状况下的数据
C.同一化学反应,化学计量数不同,ΔH不同,化学计量数相同而状态不同,ΔH也不相同
D.化学反应过程所吸收或放出的热量与参加反应的物质的物质的量成正比
难度: 中等查看答案及解析
-
下列说法正确的是
A.焓变单位是kJ•mol−1,是指1 mol物质参加反应时的能量变化
B.当反应放热时ΔH>0,反应吸热时ΔH<0
C.一个化学反应中,当反应物的总能量大于生成物的总能量时,反应放热,ΔH为“−”
D.一个化学反应中,生成物总键能大于反应物的总键能时,反应吸热,ΔH为“+”
难度: 中等查看答案及解析
-
下列热化学方程式中书写正确的是
A.2SO2+O2
2SO3 ΔH = −196.6 kJ/mol
B.H2(g)+
O2(g)
H2O(l) ΔH = −285.8 kJ/mol
C.2H2(g)+O2(g)
2H2O(l) ΔH = −571.6 kJ
D.C(s)+O2(g)
CO2(g) ΔH = +393.5 kJ/mol
难度: 中等查看答案及解析
-
热化学方程式C(s)+H2O(g)
CO(g)+H2(g) ΔH=+131.3 kJ·mol−1表示
A.碳和水反应吸收131.3 kJ能量
B.1 mol碳和1 mol水反应生成一氧化碳和氢气,并吸收131.3 kJ热量
C.1 mol固态碳和1 mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3 kJ
D.1个固态碳原子和1分子水蒸气反应吸热131.1 kJ
难度: 中等查看答案及解析
-
下列实验操作中一定会产生误差的是
A.在中和热的测定实验中用Ba(OH)2代替NaOH,用H2SO4代替HCl
B.将pH试纸用蒸馏水润湿后测某溶液的pH
C.用碱石灰来干燥氨气
D.使用天平称量时误将药品与砝码的位置放反
难度: 中等查看答案及解析
-
已知1 g火箭燃料肼(N2H4)气体燃烧生成N2(g)和H2O(g)时,放出16.7 kJ的热量,则该反应的热化学方程式正确的是
A.N2H4+O2
N2+2H2O ΔH=−534.4 kJ·mol−1
B.N2H4(g)+O2(g)
N2(g)+2H2O(g) ΔH=−534.4 kJ·mol−1
C.N2H4(g)+O2(g)
N2(g)+2H2O(g) ΔH=+534.4 kJ·mol−1
D.
N2H4(g)+
O2(g)
N2(g)+H2O(g) ΔH=−16.7 kJ·mol−1
难度: 中等查看答案及解析
-
已知以下三个热化学方程式:
2H2S(g)+3O2(g)
2SO2(g)+2H2O(l) ΔH=a kJ·mol−1
2H2S(g)+O2(g)
2S(s)+2H2O(l) ΔH=b kJ·mol−1
2H2S(g)+O2(g)
2S(s)+2H2O(g) ΔH=c kJ·mol−1
下列关于a、b、c三者关系的表述正确的是
A.a>b>c B.a>c>b C.c>b>a D.b>a>c
难度: 中等查看答案及解析
-
在稀溶液中,强酸与强碱反应的中和热为57.3 kJ/mol。下列热化学方程式中正确的是
A.HNO3(aq)+KOH(aq)
H2O(l)+KNO3(aq) ΔH >−57.3 kJ/mol
B.HNO3(aq)+NH3·H2O(aq)
H2O(l)+NH4NO3(aq) ΔH <−57.3 kJ/mol
C.CH3COOH(aq)+KOH(aq)
H2O(l)+CH3COOK(aq) ΔH <−57.3 kJ/mol
D.CH3COOH(aq)+NH3·H2O(aq)
H2O(l)+CH3COONH4(aq) ΔH >−57.3 kJ/mol
难度: 中等查看答案及解析
-
强酸与强碱的稀溶液发生中和反应的热效应为H+(aq)+OH−(aq)
H2O(l) ΔH=−57.3 kJ/mol。稀醋酸、浓硫酸、稀硝酸分别与0.1 mol·L−1的NaOH溶液恰好完全反应,放出的热量与消耗NaOH溶液的体积之间的关系如图所示(CH3COOH电离要吸热)。则下列描述正确的是
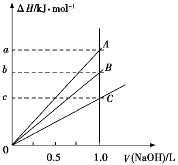
A.A表示稀硝酸与NaOH溶液的反应
B.B表示稀醋酸与NaOH溶液的反应
C.b=5.73
D.C表示浓硫酸与NaOH溶液的反应
难度: 中等查看答案及解析
-
CO(g)与H2O(g)反应过程的能量变化如图所示,下列说法正确的是
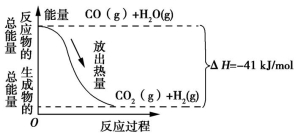
A.该反应为吸热反应
B.CO(g)和H2O(g)的总能量大于CO2(g)和H2(g)的总能量
C.该反应的热化学方程式:CO(g)+H2O(g)
CO2(g)+H2(g) ΔH=+41 kJ/mol
D.1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和1 mol H2O(g)要放出41 kJ的热量
难度: 中等查看答案及解析