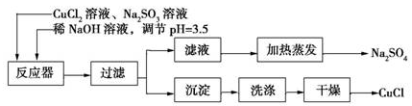
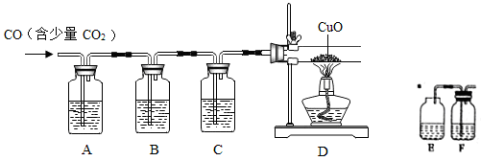
-
下列关于物质的量浓度表述正确的是
A.0.3 mol·L-1 Na2SO4溶液中含有Na+和SO总物质的量为0.9 mol
B.50mL 1 mol·L-1的KCl溶液和100mL 0.5 mol·L-1MgCl2溶液中,Cl-的物质的量浓度不相等
C.用1 L水吸收22.4 L氨气所得氨水的浓度是1 mol·L-1
D.10 ℃时0.35 mol·L-1的KCl饱和溶液100 mL,蒸发掉5 g水,再冷却到10 ℃时,它的物质的量浓度仍为0.35 mol·L-1
难度: 中等查看答案及解析
-
下列常用化学品标志所涉及的物质中,一定能发生氧化还原反应的是
A
B
C
D




难度: 简单查看答案及解析
-
下列有机物命名正确的是( )
A.
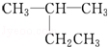 :2﹣乙基丙烷
:2﹣乙基丙烷B.CH3CH2CH2CH2OH:1﹣丁醇
C.
 :间二甲苯
:间二甲苯D.
 :2﹣甲基﹣2﹣丙烯
:2﹣甲基﹣2﹣丙烯难度: 中等查看答案及解析
-
下列情况会对人体健康造成较大危害的是
A.用SO2漂白食品
B.用食醋清洗热水瓶胆内壁附着的水垢(CaCO3)
C.自来水中通入少量Cl2进行消毒杀菌
D.用小苏打(NaHCO3)发酵面团制作馒头
难度: 简单查看答案及解析
-
下列关于硅的说法,不正确的是( )
A.光导纤维的主要成分是二氧化硅
B.二氧化硅是硅酸的酸酐,但不可以用它和水直接反应来制取硅酸
C.硅的化学性质不活泼,但在常温下也可和某些物质反应
D.盛放硅酸钠溶液的试剂瓶不能用玻璃塞的主要原因是硅酸钠溶液水解呈碱性
难度: 中等查看答案及解析
-
设NA代表阿伏加德罗常数的值,下列叙述正确的是
A.常温常压下,28 g 14CO和N2的混合物所含的质子数为14NA
B.常温下
,100 mL 1 mol·L-1Na2CO3溶液中阴离子总数大于0.1 NA
C.将NA个NH3分子溶于1 L水中得到1 mol·L-1的氨水
D.1 mol Cl2分别与足量的铁或氢氧化钠溶液反应,转移电子数均为2NA
难度: 中等查看答案及解析
-
下列说法或表示方法正确的是( )
A.若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由“C(石墨)===C(金刚石) ΔH=1.9 kJ·mol”可知,金刚石比石墨稳定
C.在101 kPa时,2 g H2 完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)===2H2O(l) ΔH=-285.8 kJ/mol
D.在稀溶液中:H++OH-===H2O ΔH=-57.3 kJ·mol ,若将含1 mol H2SO4与含2 mol NaOH的溶液混合,放出的热量等于114.6 kJ
难度: 中等查看答案及解析
-
下列实验操作中不正确的是
A. 用规格为10mL的量筒量取6.2mL的液体
B. 用蒸发方法使NaCl从溶液中析出时,应边加热边搅拌直至溶液完全蒸干
C. 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
D. 制取蒸馏水时,冷凝管中冷凝水应由下口进,上口出
难度: 中等查看答案及解析
-
绿色电源“二甲醚【(CH3)2O】—氧气燃料电池”的工作原理如下图所示,下列说法正确的是( )

A.氧气应从c处通入,电极Y上发生的反应为:O2+4e-+2H2O=4OH-
B.电池在放电过程中,电极X周围溶液的pH增大
C.当该电池向外电路提供2 mol电子时消耗O2约为11.2L
D.二甲醚应从b处加入,电极X上发生的反应为:(CH3)2O-12e-+3H2O=2CO2+12H+
难度: 困难查看答案及解析
-
第3周期元素的基态原子中,不可能出现d电子,主要依据是
A. 能量守恒原理
B. 泡利不相容原理
C. 洪特规则
D. 近似能级图中的顺序3d轨道能量比4s轨道高
难度: 中等查看答案及解析
-
下列操作中,能使电离平衡H2O
H++OH-,向右移动且溶液呈酸性的是( )
A.向水中加入NaHSO4溶液 B.向水中加入Al2(SO4)3固体
C.向水中加入Na2CO3溶液 D.将水加热到100℃,使pH=6
难度: 中等查看答案及解析
-
下列能说明氯元素的非金属性比硫元素强的事实是( )
①HCl比H2S稳定 ②HClO氧化性比H2SO4强
③HClO4酸性比H2SO4强 ④Cl2能与H2S反应生成S
⑤Cl原子最外层有7个电子,S原子最外层有6个电子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS。
A. ①②④⑤ B. ①②③⑥ C. ①③⑤⑥ D. ①③④⑥
难度: 中等查看答案及解析
-
色氨酸是植物体内生长素生物合成重要的前体物质,普遍存在于高等植物中。纯净的色氨酸为白色或微黄色结晶,微溶于水易溶于盐酸或氢氧化钠,其结构如图所示,下列关于色氨酸的说法不正确的是
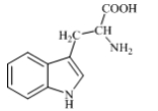
A.色氨酸的分子式为C11H12N2O2
B.色氨酸能发生取代、加成、酯化
、中和反应
C.色氨酸微溶于水而易溶于酸或碱溶液是因为其与酸、碱都能反应生成盐
D.将色氨酸与甘氨酸(NH2CH2COOH)混合,在一定条件下最多可形成三种二肽
难度: 中等查看答案及解析
-
在溶液中加入足量Na2O2后仍能大量共存的离子组是( )
A.K+、AlO2-、Cl-、SO42-
B.H+、Ba2+、Cl-、NO3-
C.Ca2+、Fe2+、NO3-、HCO3-
D.Na+、Cl-、CO32-、SO32-
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.化学反应除了生成新物质外,还伴随着能最的变化
B.物质燃烧和中和反应均放出热量
C.分解反应肯定是吸热反应
D.化学反应是吸热还是放热决定于生成物具有的总能最和反应物具有的总能量
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.体心立方是金属最密堆积的形式
B.在SiO2晶体中,并不存在单个“SiO2”分子
C.干冰中,与CO2分子等距紧邻的CO2分子有8个
D.31 g P4含有P-P键的个数为4NA
难度: 中等查看答案及解析
-
如图是某
条件下N2与H2反应过程中能量变化的曲线图。根据图像判断下列叙述中正确的是( )

A.该反应的热化学方程式为
B.a曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热数值会减小
D.反应
难度: 中等查看答案及解析
-
醋酸溶液中滴入稀氨水,溶液的导电能力发生变化,其电流强度I随氨水的加入体积V的变化曲线图是图是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
盛有O2和NO2的混合气体的量筒倒立在盛有水的水槽中,过一段时间后,量筒内的气体体积减小为原来的一半。则原混合气体中O2和NO2的体积比是( )
A.2∶1 B.1∶2 C. 3∶2 D.3∶1
难度: 困难查看答案及解析
-
由H2、O2和N2组成的混合气体在同温同压下与CO的密度相同,则该混合气体中的H2、N2、O2的体积比为
A.1:1:1 B.2:1:13 C.13:1:2 D.1:16::14
难度: 困难查看答案及解析
-
下列有关说法正确的是( )
A.锌与稀硫酸反应时加入少量硫酸铜,反应加快的主要原因是Cu2+水解增大了H+浓度
B.铅蓄电池放电时的负极和充电时的阴
极均发生氧化反应
C.电解法精炼铜时,以粗铜作阴极,纯铜作阳极
D.镀锌铁镀层破损后锌仍能减缓铁腐蚀,其原理为牺牲阳极的阴极保护法
难度: 中等查看答案及解析
-
下列物质的性质比较,正确的是( )
A. 酸性:H2SO4>HClO4>HBrO4 B. 碱性:NaOH>KOH>RbOH
C. 气态氢化物稳定性:HF>HCl>H2S D. 非金属性:P>S>Cl
难度: 中等查看答案及解析
-
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表; J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的元素。
J
R
下列说法错误的是( )
A .J的单质一定能导电
B.J、R形成的化合物JR2中J与R原子间是极性共价键
C.R、T两元素的气态氢化物中,T的气态氢化物更稳定
D.四种元素中T的最高价氧化物的水化物酸性最强
难度: 中等查看答案及解析
-
羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡: CO(g)+H2S(g)
COS(g)+H2(g),K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.反应前H2S物质的量为7mol
D.CO的平衡转化率为80%
难度: 困难查看答案及解析
-
科学家开发出一种新型锂—氧电池,其能量密度极高,效率达90%以上。电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:O2+4LiI+2H2O2I2+4LiOH
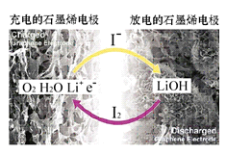
对于该电池的下列说法不正确的是( )
A.放电时负极上I- 被氧化
B.充电时Li+从阳极区移向阴极区
C.充电时阴极反应为LiOH+e-==Li+OH-
D.放电时正极反应为O2+2H2O+4Li++4e-==4LiOH
难度: 困难查看答案及解析
-
在常温条件下,下列对醋酸的叙述中,不正确的是
A.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-)
B.将pH=a的醋酸稀释为pH=a+1的过程中,c(CH3COOH)/c(H+)变小
C.浓度均为0.1 mol·L-1的CH3COOH和CH3COONa溶液等体积混合后:
c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
D.等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,存在a+b=14
难度: 困难查看答案及解析
-
在三个体积相同的密闭容器中分别充入Ne、H2、O2三种气体,当他们的温度和密度都相同时,这三种气体的压强(p)由大到小的顺序是( )
A.p(Ne)>p(H2)>p(02) B.p(O2)>p(Ne)>p(H2)
C. p(H2)>p(O2)>p(Ne) D.p(H2)>p(Ne)>p(O2)
难度: 中等查看答案及解析
-
下列实验能达到预期目的的是( )
①用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸;
②用饱和NaCl溶液除去Cl2中的少量HCl
;
③用饱和NaHCO3溶液除去CO2中的少量SO2;
④用加热的方法提取NH4Cl固体中混有的少量碘;
⑤用
醋和澄清石灰水验证蛋壳中含有碳酸盐;
⑥用米汤检验食用加碘盐中含碘;
⑦用纯碱溶液洗涤餐具;
⑧用玻璃棒搅拌漏斗中的液体以加快过滤的速度;
⑨加入盐酸以除去硫酸钠中的少量碳酸钠杂质
A.①④⑤⑨ B.②③⑤⑦ C.②③⑤⑧ D.②③⑤⑥⑦
难度: 中等查看答案及解析
-
如图是CO2电催化还原为CH4的工作原理示意图。下列说法不正确的是

A.该过程是电能转化为化学能的过程
B.铜电极的电极反应式为CO2+8H++8e-=CH4+2H2O
C.一段时间后,①池中n(KHCO3)不变
D.一段时间后,②
池中溶液的pH不一定升高
难度: 困难查看答案及解析
-
为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,然后在下列操作中选取必要的步骤和正确的操作顺序( )
①过滤;②加过量NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液
A.④②⑤ B.④①②⑤③ C.②⑤④①③ D.①④②⑤③
难度: 困难查看答案及解析