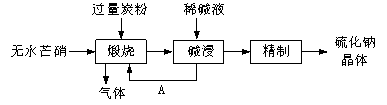
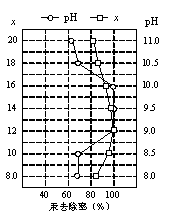
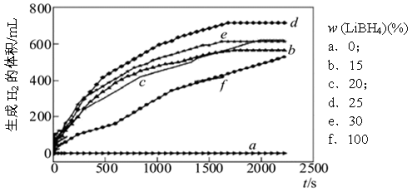
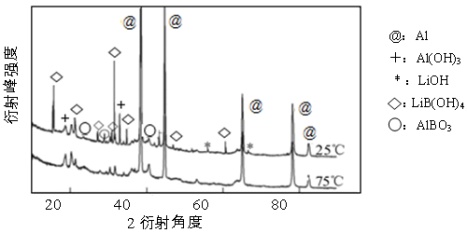
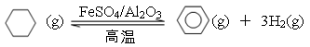-
化学与生活、生产和环境等社会实际密切相关。下列说法正确的是
A.处理废水时加入明矾作为消毒剂可以除去水中的杂质
B.利用铜、锶、钡等金属化合物的焰色反应制造节日烟花
C.高纯硅广泛应用于太阳能电池、计算机芯片和光导纤维
D.PM2.5含有的铅、镉、铬、钒、砷等元素均为对人体有害的金属元素
难度: 中等查看答案及解析
-
下列有关化学用语的表示正确的是
A.质量数为37的氯原子:
B.二氧化碳分子的比例模型:
C. NH4Br的电子式:
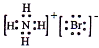
D.对羟基苯甲醛的结构简式:
难度: 中等查看答案及解析
-
常温下,下列溶液中各组离子一定大量共存的是
A.澄清透明的溶液中:K+、Al3+、SO42-、MnO4-
B.0.1 mol·L-1CH3COONa溶液中:H+、Ca2+、Cl-、NO3-
C.滴入KSCN显血红色的溶液中:NH4+、Mg2+、S2-、Cl-
D.c(H+)=1×10-13 mol·L-1的溶液中:Na+、NH4+、SO42-、CO32-
难度: 中等查看答案及解析
-
下列有关物质的性质与应用对应关系不正确的是
A.锂质量轻、比能量大,可用作电池负极材料
B.SO2具有漂白性,可用作熏蒸食用粉丝使其增白
C.酒精是良好的有机溶剂,可洗去皮肤表面沾有的苯酚
D.Al(OH)3受热分解吸收大量的热,生成耐高温的Al2O3,可用作阻燃剂
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是
A.1mol甲醇中含有C—H键的数目为4NA
B.常温下,2.24LCl2完全与NaOH溶液反应,转移的电子数目一定为0.1 NA
C.7.8g由Na2S和Na2O2组成的混合物中含有阴离子的数目为 0.1NA
D.80℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2 NA
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.铜溶于稀硝酸:Cu+2H++NO3-=Cu2++NO2↑+H2O
B.用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I 2+6OH-
C.向NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D.向新制Cu(OH)2悬浊液中加入乙醛溶液并加热:CH3CHO+2Cu(OH)2+OH-
CH3COO-+Cu2O↓+3H2O
难度: 中等查看答案及解析
-
下列有关实验装置(部分夹持装置已省略)进行的相应实验,能达到实验目的的是
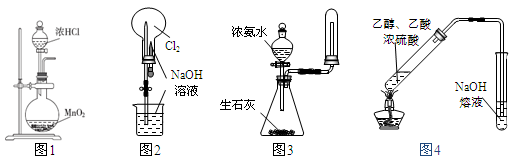
A.用图1所示装置可制取Cl2
B.用图2所示装置可完成“喷泉”实验
C.用图3所示装置可制取并收集干燥纯净的NH3
D.用图4所示装置可用于实验室制取乙酸乙酯
难度: 中等查看答案及解析
-
已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如下图所示(部分产物略去),则下列有关物质的推断不正确的是

A.若A是铁,则E可能为稀硝酸
B.若A是CuO,E是碳,则B为CO
C.若A是AlCl3溶液,E可能是氨水
D.若A是NaOH溶液,E是CO2,则B为NaHCO3
难度: 中等查看答案及解析
-
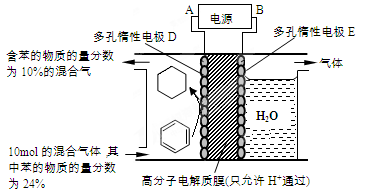
瑞典ASES公司设计的曾用于驱动潜艇的液氨—液氧燃料电池示意图如下图所示,有关说法正确的是
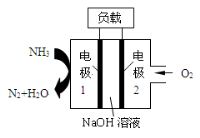
A.电极2发生氧化反应
B.电池工作时,Na+ 向负极移动
C.电流由电极1经外电路流向电极2
D.电极1发生的电极反应为:2NH3+6OH—-6e-=N2↑+6H2O
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z是同周期中原子半径最大的元素,W的最高正价为+7价。下列说法正确的是
A.简单离子半径大小顺序:rW>rZ> rY
B.元素W的氧化物对应水化物的酸性比Y的强
C.X与Y形成的原子晶体X3Y4的熔点可能比金刚石高
D.X与W形成的化合物和Z与W形成的化合物的化学键类型相同
难度: 中等查看答案及解析
-
下列有关说法正确的是
A.在轮船表面涂刷富锌油漆,能有效防止船体在海水中被腐蚀
B.0.1 mol·L-1氨水加水稀释后,溶液中
的值减小
C.用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
D.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0
难度: 中等查看答案及解析
-
化合物Ⅲ是合成中药黄芩中的主要活性成分的中间体,合成方法如下:
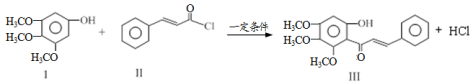
下列有关叙述正确的是
A.I在空气中能稳定存在
B.II中所有原子均有可能共面
C.可用FeCl3溶液鉴别有机物II和III
D.1mol产物III与足量溴水反应,消耗Br2的物质的量为1.5mol
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是
选项
实验操作
实验现象
结论
A
向浓度均为0.1 mol·L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液
先出现黄色沉淀
Ksp(AgCl)<sp(AgI)
B
向苯酚浊液中加入Na2CO3溶液
溶液变澄清
酸性:苯酚>HCO3—
C
向蓝色石蕊试纸上滴加新制氯水
试纸边缘呈红色色,中间为白色
氯水既有酸性又有还原性
D
淀粉与稀硫酸混和一段时间后,滴加银氨溶液并水浴
无银镜出现
淀粉没有水解
难度: 中等查看答案及解析
-
常温下,用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1CH3COOH溶液的滴定曲线如图所示。下列说法正确的是
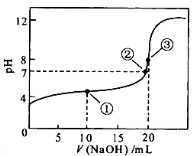
A.点①所示溶液中:c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)
B.点②所示溶液中:c(Na+)+c(H+)=c(CH3COO-) +c(CH3COOH) +c(OH-)
C.点③所示溶液中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.在整个滴定过程中:溶液中
始终不变
难度: 中等查看答案及解析
-
900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应:
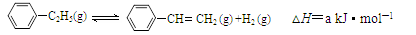 。经一段时间后达到平衡。反应过程中测定的部分数据见下表:
。经一段时间后达到平衡。反应过程中测定的部分数据见下表:时间/min
0
10
20
30
40
n(乙苯)/mol
0.40
0.30
0.24
n2
n3
n(苯乙烯)/mol
0.00
0.10
n1
0.20
0.20
下列说法正确的是
A.反应在前20 min的平均速率为v(H2)=0.004mol·L-1·min-1
B.保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08 mol·L-1,则a<0
C.保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率为50.0%
D.相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,达到平衡前v(正)>v(逆)
难度: 中等查看答案及解析
-
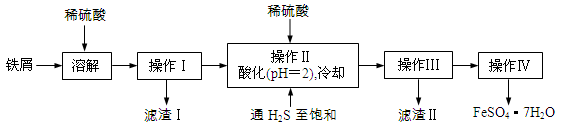
(12分)由徐光宪院士发起、院士学子同创的《分子共和国》科普读物最近出版了。全书形象生动地戏说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、 H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星。
(1)写出Fe3+的电子排布式 。
(2)与CO2互为等电子体的一种离子为 (填化学式)。
(3)NH3分子中氮原子的杂化轨道类型是 。
(4)1 mol CH3COOH中含有的σ键的数目为 。
(5)TiO2的天然晶体中,最稳定的一种晶体结构如图,黑球表示 原子。
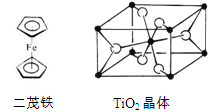
(6)二茂铁(C5H5)2Fe是Fe2+与环戊二烯基离子结合形成的小分子化合物(如上图),该化合物中Fe2+与环戊二烯基离子之间以 相结合(填字母)。
a.离子键
b.金属键
c.配位键
d.氢键
e.范德华力
难度: 困难查看答案及解析