-
化学与生活密切相关,下列说法正确的是
A.高纯度的硅单质广泛用于制作光导纤维
B.绚丽缤纷的烟花中添加了含钾、钙、钠、铜等金属元素的化合物
C.汽车尾气中氮氧化物的产生主要是由于汽油中含有氮元素
D.埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mol·L-1 NaOH溶液:K+、Na+、SO42-、CO32-
B.能与铝反应放出氢气的溶液中:K+、SO42-、NO3-、NH4+
C.0.1 mol·L-1 FeCl3溶液:K+、NH4+、I-、SCN-
D.c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、NO3-
难度: 中等查看答案及解析
-
下列关于有机化合物的说法错误的是
A.2,2-甲基丙烷也称新戊烷
B.由乙烯生成乙醇属于加成反应
C.分子式为C5H11Cl的有机物共有8种(不含立体异构)
D.所有的糖类、油脂、蛋白质都可以发生水解反应
难度: 简单查看答案及解析
-
X、Y、Z、R、W是5种短周期元素,原子序数依次增大;它们可组成离子化合物Z2Y和共价化合物RY3、XW4;已知Y、R同主族,Z、R、W同周期。下列说法错误的是
A. 原子半径:Z>R>Y
B. 气态氢化物稳定性:HmW>HnR
C. Y、Z、R三种元素组成的化合物水溶液一定显中性
D. X2W6分子中各原子均满足8电子结构
难度: 中等查看答案及解析
-
下列实验操作能达到目的的是
实验目的
实验操作
A
制备Fe(OH)3胶体
将NaOH浓溶液滴加到饱和FeCl3溶液中
B
配制氯化铁溶液
将氯化铁溶解在较浓的盐酸中再加水稀释
C
确定Na2SO3样品是否部分被
氧化
取样于试管中,加入稀硝酸酸化,再滴加BaCl2溶液,观察是否有白色沉淀生成
D
检验乙醇发生消去反应生成
乙烯
将生成的气体直接通入盛有酸性高锰酸钾溶液的试剂瓶,观察溶液是否褪色
难度: 中等查看答案及解析
-
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,其总反应为:2CH2=CH2+O2→2CH3CHO。下列有关说法正确的是
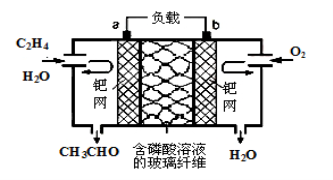
A.该装置能量转化形式是电能转化为化学能
B.负极反应式为:CH2=CH2-2e-+H2O=CH3CHO +2H+
C.每有0.1 mol O2反应,则向负极迁移的H+的物质的量为0.4 mol
D.电子移动方向:电极a→磷酸溶液→电极b
难度: 中等查看答案及解析
-
已知常温时CH3COOH和NH3•H2O 的电离常数相等,现向10 mL浓度为0.1 mol•L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中下列说法正确的是
A.水的电离程度始终增大
B.c(NH4+)/c(NH3•H2O)先增大再减小
C.当加入氨水的体积为10 mL时,溶液中的离子浓度:c(NH4+)=c(CH3COO-)﹥c(H+)= c(OH-)
D.当加入氨水的体积为10 mL时,溶液中的pH=7,由水电离出的c(H+)=1×10-7
难度: 中等查看答案及解析


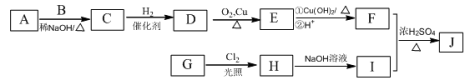
 (R为烃基),其中一种辣椒素酯类化合物J的合成路线如下:
(R为烃基),其中一种辣椒素酯类化合物J的合成路线如下: