-
甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.58 kJ•mol-1
CH3OH(g)+H2O(g) △H1=-49.58 kJ•mol-1
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g) CH3OH(g) △H3=-90.77 kJ•mol-1
CH3OH(g) △H3=-90.77 kJ•mol-1
回答下列问题:
(1)反应Ⅱ的△H2= ,若反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为K1、K2、K3,则K2= (用K1、K3表示)。
(2)反应Ⅲ自发进行条件是 (填“较低温度”、“较高温度”或“任何温度”)。
(3)在一定条件下2 L恒容密闭容器中充入3 mol H2和1.5 mol CO2,仅发生反应Ⅰ,实验测得不同反应温度与体系中CO2的平衡转化率的关系,如下表所示。
| 温度(℃) | 500 | T |
| CO2的平衡转化率 | 60℅ | 40℅ |
①T 500℃(填“高于”或“低于”)。
②温度为500℃时,该反应10 min时达到平衡:
a.用H2表示该反应的速率为 ;
b.该温度下,反应I的平衡常数K= 。
(4)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应I、Ⅱ、Ⅲ),测得不同温度下体系达到平衡时CO2的转化率(a)及CH3OH的产率(b),如图所示。
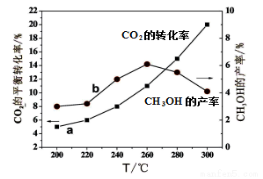
①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是 (选填编号)。
A.升高温度 B.缩小容器体积 C.分离出甲醇 D.增加CO2的浓度
②据图可知当温度高于260℃后,CO的浓度随着温度的升高而 (填“增大”、“减小”、“不变”或“无法判断”)。
-
甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.58 kJ•mol-1
CH3OH(g)+H2O(g) △H1=-49.58 kJ•mol-1
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g) CH3OH(g) △H3=-90.77 kJ•mol-1
CH3OH(g) △H3=-90.77 kJ•mol-1
回答下列问题:
(1)反应Ⅱ的△H2=_________,若反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为K1、K2、K3,则K2=________(用K1、K3表示)。
(2)反应Ⅲ自发进行条件是___________(填“较低温度”、“较高温度”或“任何温度”)。
(3)在一定条件下2 L恒容密闭容器中充入3 mol H2和1.5 mol CO2,仅发生反应Ⅰ,实验测得不同反应温度与体系中CO2的平衡转化率的关系,如下表所示。
| 温度(℃) | 500 | T |
| CO2的平衡转化率 | 60℅ | 40℅ |
①T______500℃(填“>”、“<” 、“=”)。
②温度为500℃时,该反应10 min时达到平衡。用H2表示该反应的反应速率v(H2)=______________;该温度下,反应I的平衡常数K=______________L2/mol2
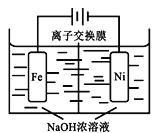
(4)由CO2制备甲醇还需要氢气。工业上用电解法制取Na2FeO4,同时获得氢气:Fe+2H2O+2OH− FeO42−+3H2↑,工作原理如图所示。电解一段时间后,c(OH−)降低的区域在__________ (填“阴极室”或“阳极室”)。该室发生的电极反应式为:___________________________。
FeO42−+3H2↑,工作原理如图所示。电解一段时间后,c(OH−)降低的区域在__________ (填“阴极室”或“阳极室”)。该室发生的电极反应式为:___________________________。
-
甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H1=-49.58 kJ•mol-1
CH3OH(g)+H2O(g) △H1=-49.58 kJ•mol-1
反应Ⅱ:CO2(g)+H2(g)  CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)  CH3OH(g) △H3=-90.77 kJ•mol-1
CH3OH(g) △H3=-90.77 kJ•mol-1
回答下列问题:
(1)反应Ⅱ的△H2=______________。
(2)反应Ⅲ自发进行的原因是___________。
(3)一定温度下,在一个容积为2L的密闭容器中充入4mol SO2和2mol O2,发生反应2SO2(g)+O2(g) 2SO3(g);2min后达到平衡,测得容器中SO3的浓度为0.6mol/L。
2SO3(g);2min后达到平衡,测得容器中SO3的浓度为0.6mol/L。
①下列能说明反应达到平衡状态的是____________________。
A.v(O2)正=2v(SO3)逆 B.气体的平均相对分子质量不变
C.气体的密度不变 D.气体的分子总数不变
②从反应开始到平衡,用SO2的浓度变化表示的反应速率为____________。
③该温度下,此反应的化学平衡常数为___________。(结果保留两位小数)
④达到平衡后,为同时提高反应速率和SO3的生成量,以下措施一定可行的是______
A.升高温度 B.缩小容器体积 C.分离出SO3 D.改变催化剂
⑤若向平衡体系中再加入4mol SO2和2mol O2,化学平衡________移动(填“向右”、“向左”或“不”),再次达到平衡时SO2的转化率___________。(填“增大”、“减小”或“不变”)。
(4)25℃时,向浓度均为0.1mol/L的NaBr和KI的混合溶液中逐滴加入AgNO3溶液,当两种沉淀共存时,c(Br-)与c(I-)的比值为______。(结果保留两位小数)[Ksp(AgBr)=5.4×10-13,Ksp(AgI)=8.5×10-17]
-
甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g) CH3OH(g) △H3=-90.77kJ·mol-1
CH3OH(g) △H3=-90.77kJ·mol-1
回答下列问题:
(1)反应Ⅱ的△H2=______________。
(2)反应Ⅲ能够自发进行的条件是__ (填“较低温度”、“ 较高温度”或“任何温度”)
(3)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是________。
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1
D.甲醇的百分含量不再变化
(4)对于反应Ⅰ,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是____。
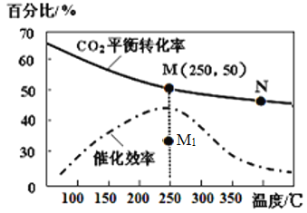
A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
B.温度低于250 ℃时,随温度升高甲醇的产率增大
C.M点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(5)若在1L密闭容器中充入3molH2和1molCO2发生反应Ⅰ,250℃时反应的平衡常数K=__________;若要进一步提高甲醇积分数。可采取的措施有________。
-
甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g) CH3OH(g) △H3=-90.77kJ·mol-1
CH3OH(g) △H3=-90.77kJ·mol-1
回答下列问题:
(1)反应Ⅱ的△H2=______________________。
(2)反应Ⅲ能够自发进行的条件是__________(填“较低温度”、“ 较高温度”或“任何温度”)。
(3)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是________。
A.混合气体的密度不再变化B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1D.甲醇的百分含量不再变化
(4)对于反应Ⅰ,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是____。
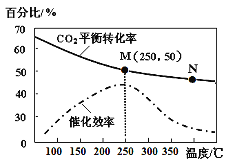
A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率仍位于M
B.温度低于250℃时,随温度升高甲醇的产率增大
C.M点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(5)若在1L密闭容器中充入3molH2和1molCO2发生反应Ⅰ,则图中M点时,产物甲醇的体积分数为_________________;该温度下,反应的平衡常数K=______________L2/mol2;若要进一步提高甲醇体积分数,可采取的措施有____________________________________________。
-
甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g) CH3OH(g) △H3=-90.77kJ·mol-1
CH3OH(g) △H3=-90.77kJ·mol-1
回答下列问题:
(1)反应Ⅱ的△H2=______________。
(2)反应Ⅲ能够自发进行的条件是__________ (填“较低温度”、“ 较高温度”或“任何温度”)
(3)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是________。
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1
D.甲醇的百分含量不再变化
(4)对于反应Ⅰ,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是__________。
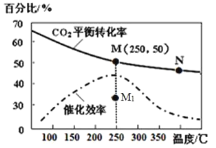
A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
B.温度低于250 ℃时,随温度升高甲醇的产率增大
C.M点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(5)若在1L密闭容器中充入3molH2和1molCO2发生反应Ⅰ,250℃时反应的平衡常数K=______;若要进一步提高甲醇体积分数。可采取的措施有_________________。
(6)下图是电解Na2CO3溶液的装置图。
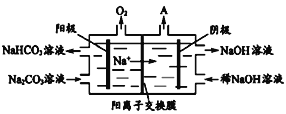
阴极的电极反应式为________________
-
甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g) CH3OH(g) △H3=-90.77kJ·mol-1
CH3OH(g) △H3=-90.77kJ·mol-1
回答下列问题:
(1)反应Ⅱ的△H2=_________________。
(2)反应Ⅲ能够自发进行的条件是_______________(填“较低温度” “较高温度”或“任何温度” )。
(3)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是______。
A.混合气体的密度不再变化 B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1
D.甲醇的百分含量不再变化
(4)对于反应Ⅰ,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是__________。
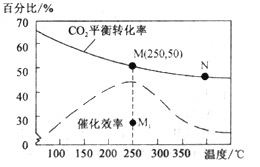
A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
B.温度低于250 ℃时,随温度升高甲醇的产率增大
C.M 点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(5)已知下列物质在20℃下的Ksp如下,试回答下列问题:
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 货色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.4×10-13 | 8.3×10-17 | 6.3×10-50 | 2.0×10-12 |
①20℃时,上述五种银盐饱和溶液中,Ag+物质的量浓度由大到小的顺序是____________。
②向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时c(Br-)/c(Cl-)=________________。
③ 测定水体中氯化物的含量,常用标准硝酸银法进行滴定,滴定时,应加入的指示剂是____。
A.KBr B.KI C.K2S D.K2CrO4
(6)已知25℃时Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33。
①在25℃下,向浓度均为0.1 mol·L-1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成______________沉淀(填化学式)。
②溶液中某离子物质的量浓度低于1.0×10-5 mol·L-1时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+刚好完全沉淀时,测定c(Al3+)=0.2mol·L-1。此时所得沉淀中___________(填“还含有”或“不含有”)Al(OH)3,并请写出计算过程。
-
甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g) CH3OH(g) △H3=-90.77kJ·mol-1
CH3OH(g) △H3=-90.77kJ·mol-1
回答下列问题:
(1)反应Ⅱ的△H2=_________________。
(2)反应Ⅲ能够自发进行的条件是_______________(填“较低温度” “较高温度”或“任何温度” )。
(3)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是______。
A.混合气体的密度不再变化 B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1
D.甲醇的百分含量不再变化
(4)对于反应Ⅰ,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是__________。
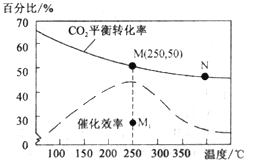
A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
B.温度低于250 ℃时,随温度升高甲醇的产率增大
C.M 点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(5)已知下列物质在20℃下的Ksp如下,试回答下列问题:
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 货色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.4×10-13 | 8.3×10-17 | 6.3×10-50 | 2.0×10-12 |
①20℃时,上述五种银盐饱和溶液中,Ag+物质的量浓度由大到小的顺序是____________。
②向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时c(Br-)/c(Cl-)=________________。
③ 测定水体中氯化物的含量,常用标准硝酸银法进行滴定,滴定时,应加入的指示剂是____。
A.KBr B.KI C.K2S D.K2CrO4
(6)已知25℃时Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33。
①在25℃下,向浓度均为0.1 mol·L-1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成______________沉淀(填化学式)。
②溶液中某离子物质的量浓度低于1.0×10-5 mol·L-1时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+刚好完全沉淀时,测定c(Al3+)=0.2mol·L-1。此时所得沉淀中___________(填“还含有”或“不含有”)Al(OH)3,并请写出计算过程。
-
甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g) CH3OH(g) △H3=-90.77kJ·mol-1
CH3OH(g) △H3=-90.77kJ·mol-1
回答下列问题:
(1)反应Ⅱ的△H2=______________。
(2)反应Ⅲ能够自发进行的条件是______________(填“较低温度”、“ 较高温度”或“任何温度”)。
(3)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是________。
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1
D.甲醇的百分含量不再变化
(4)对于反应Ⅰ,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是____。
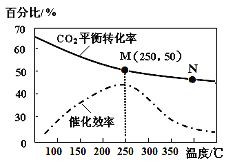
A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
B.温度低于250℃时,随温度升高甲醇的产率增大
C.M点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(5)若在1L密闭容器中充入3molH2和1molCO2发生反应Ⅰ,则图中M点时,产物甲醇的体积分数为_____;该温度下,反应的平衡常数K=__________;若要进一步提高甲醇积分数。可采取的措施有________。
-
甲醇来源丰富,有广泛的用途和广阔的应用前景,工业上可以利用CO和CO2生产甲醇,同时可以利用甲醇生产丙烯。制备甲醇,丙烯过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.0kJ/mol
CH3OH(g)+H2O(g) △H1=-49.0kJ/mol
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g) CH3OH(g) △H3=-90.0kJ/mol
CH3OH(g) △H3=-90.0kJ/mol
反应Ⅳ:3CH3OH(g) C3H6(g)+3H2O(g) △H4=-31.0kJ/mol
C3H6(g)+3H2O(g) △H4=-31.0kJ/mol
回答下列问题:
(1)反应Ⅱ的ΔH2=________。
(2)反应Ⅲ能够自发进行的条件是________(填“较低温度”“较高温度”或“任何温度”),据研究该反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于保持催化剂Cu2O的量不变,原因是________(用化学方程式表示)。
(3)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是________。
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2的生成速率与CH3OH的生成速率相等
D.容器的压强不再变化
(4)甲醇生产丙烯的同时,还生成乙烯。在某催化剂作用下,2L密闭容器中加入0.5mol甲醇,经过相同时间后测得甲醇转化率及丙烯的选择性(生成丙烯的甲醇与甲醇转化量的比值)与反应温度之间的关系如图所示。计算600℃时反应甲醇生产丙烯的反应Ⅳ平衡常数________。若将容器体积压缩为1L,其他条件不变,在如图中作出甲醇平衡转化率随温度的变化曲线。________。
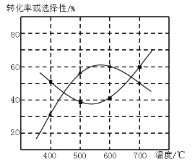
(5)研究表明,甲醇可由CO2在强酸性水溶液中通过电解合成,则生成甲醇的反应电极反应式:_______。
CH3OH(g)+H2O(g) △H1=-49.58 kJ•mol-1
CO(g)+H2O(g) △H2
CH3OH(g) △H3=-90.77 kJ•mol-1









