-
甲醇来源丰富,有广泛的用途和广阔的应用前景,工业上可以利用CO和CO2生产甲醇,同时可以利用甲醇生产丙烯。制备甲醇,丙烯过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.0kJ/mol
CH3OH(g)+H2O(g) △H1=-49.0kJ/mol
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g) CH3OH(g) △H3=-90.0kJ/mol
CH3OH(g) △H3=-90.0kJ/mol
反应Ⅳ:3CH3OH(g) C3H6(g)+3H2O(g) △H4=-31.0kJ/mol
C3H6(g)+3H2O(g) △H4=-31.0kJ/mol
回答下列问题:
(1)反应Ⅱ的ΔH2=________。
(2)反应Ⅲ能够自发进行的条件是________(填“较低温度”“较高温度”或“任何温度”),据研究该反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于保持催化剂Cu2O的量不变,原因是________(用化学方程式表示)。
(3)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是________。
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2的生成速率与CH3OH的生成速率相等
D.容器的压强不再变化
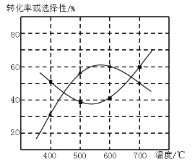
(4)甲醇生产丙烯的同时,还生成乙烯。在某催化剂作用下,2L密闭容器中加入0.5mol甲醇,经过相同时间后测得甲醇转化率及丙烯的选择性(生成丙烯的甲醇与甲醇转化量的比值)与反应温度之间的关系如图所示。计算600℃时反应甲醇生产丙烯的反应Ⅳ平衡常数________。若将容器体积压缩为1L,其他条件不变,在如图中作出甲醇平衡转化率随温度的变化曲线。________。
(5)研究表明,甲醇可由CO2在强酸性水溶液中通过电解合成,则生成甲醇的反应电极反应式:_______。
-
甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。
I.用CO2生产甲醇、乙醇
(1)已知:H2的燃烧热为-285.8 kJ/mol,CH3OH(l)的燃烧热为-725.8kJ/mol,CH3OH(g)=CH3OH(l) △H= -37.3 kJ/mol,则CO2(g)+3H2(g)=CH3OH(g)+ H2O(1) △H=____kJ/mol。
(2)将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应[生成 H2O(g)],如图1表示压强为0.1 MPa和5.0 MPa下CO2转化率随温度的变化关系。
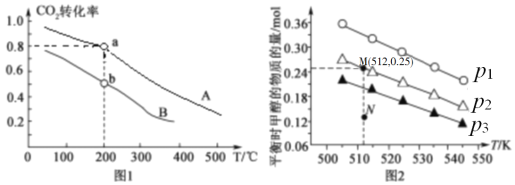
①a、b两点化学反应速率分别用Va、Vb,表示,则Va ___Vb(填“大于”、“小于”或“等于”)。
②列出a点对应的平衡常数表达式K= ____________________。
(3)在1.0 L恒容密闭容器中投入1 mol CO2和2.75 mol H2发生反应:CO2(g)+3H2(g)  CH3OH (g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是_____。
CH3OH (g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是_____。
A.该反应的正反应为放热反应
B.压强大小关系为p1<p2<p3
C.M点对应的平衡常数K的值约为1.04×10-2
D.在p2及512 K时,图中N点υ(正)<υ(逆)
(4)CO2催化加氢合成乙醇的反应为:2CO2(g)+6H2(g)  C2H5OH(g) +3H2O(g) △H;m代表起始时的投料比,即m=
C2H5OH(g) +3H2O(g) △H;m代表起始时的投料比,即m=
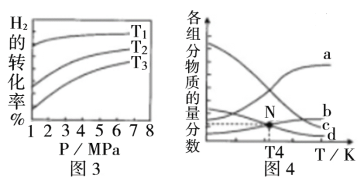
①图3中投料比相同,温度T3>T2>T1,则该反应的焓变△H____0(填“>”、“<”)。
②m=3时,该反应达到平衡状态后p(总)=20a MPa,恒压条件下各物质的物质的量分数与温度的关系如图4所示,则曲线b代表的物质为_________(填化学式),T4温度时,反应达到平衡时物质d的分压p(d)=___________。
Ⅱ.甲醇的应用
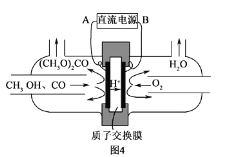
(5)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图5所示。
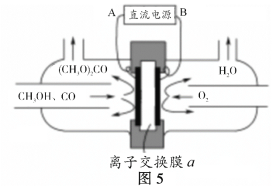
离子交换膜a为_____(填“阳膜”、“阴膜”),阳极的电极反应式为______________。
-
甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。
Ⅰ.用CO2生产甲醇
(1)已知:H2的燃烧热为-285.8kJ/mol,CH3OH(l)的燃烧热为-725.8kJ/mol,
CH3OH(g)=CH3OH(l) ΔH=-37.3kJ/mol
则CO2(g)+3H2(g) CH3OH(g)+H2O(l)ΔH=__kJ/mol。
CH3OH(g)+H2O(l)ΔH=__kJ/mol。
(2)将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应,如图1两条曲线分别表示压强为0.1MPa和5.0MPa下CO2转化率随温度的变化关系。
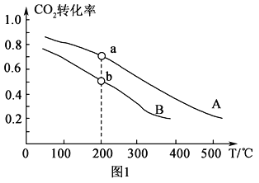
其中a点的平衡常数表达式为:__。
②a,b两点化学反应速率分别用Va、Vb表示,则Va__Vb(填“大于”、“小于”或“等于”)。
(3)在1.0L恒容密闭容器中投入1molCO2和2.75molH2发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是__。
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是__。
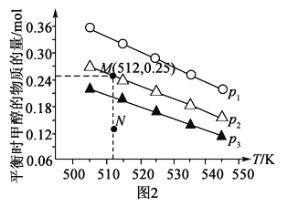
A.该反应的正反应为放热反应
B.压强大小关系为p1<p2<p3
C.M点对应的平衡常数K的值约为1.04×10-2
D.在p2及512K时,图中N点v(正)<v(逆)
Ⅱ.用CO生产甲醇
(4)已知:CO(g)+2H2(g) CH3OH(g),如图3是该反应在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g),如图3是该反应在不同温度下CO的转化率随时间变化的曲线。
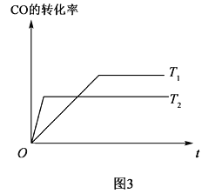
①该反应的焓变ΔH__0(填“ ”、“ ”或“ ”)。
②T1和T2温度下的平衡常数大小关系是K1___K2(填“>”、“<”或“=”)。
Ⅲ.甲醇的应用
(5)甲醇制氢气。甲醇水蒸气重整制氢反应:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49kJ/mol。某温度下,将[n(H2O):n(CH3OH)]=1:1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为___。
(6)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图4所示。阳极的电极反应式为__。
-
甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。
(1)工业生产甲醇的常用方法是:CO(g)+2H2(g)  CH3OH(g) △H = —90.8kJ/mol。
CH3OH(g) △H = —90.8kJ/mol。
已知:2H2(g)+O2(g)=2H2O(l) △H = —571.6kJ/mol;
H2(g)+ O2(g)=H2O(g) △H = —241.8kJ/mol;
O2(g)=H2O(g) △H = —241.8kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H = —566.0kJ/mol
CH3OH(g) = CH3OH(l) △H = —37.3kJ/mol
①计算液体CH3OH的燃烧热为________________________。
②若在恒温恒容的容器内进行反应CO(g)+2H2(g)  CH3OH(g),下列表示该反应达到平衡状态的标志有________________________(填字母序号)。
CH3OH(g),下列表示该反应达到平衡状态的标志有________________________(填字母序号)。
A.有1个H—H键生成的同时有 3个C—H键生成
B.CO百分含量保持不变
C.容器中混合气体的压强不变化
D.容器中混合气体的密度不变化
(2)制甲醇所需要的H2,可用下列反应制取:H2O(g)+CO(g)  H2(g)+ CO2(g) △H<0,某温度下该反应的平衡常数K=1。若起始时c(CO)=1mol•L-1,c(H2O)=2mol•L-1,试回答下列问题:
H2(g)+ CO2(g) △H<0,某温度下该反应的平衡常数K=1。若起始时c(CO)=1mol•L-1,c(H2O)=2mol•L-1,试回答下列问题:
①该温度下,反应进行一阶段时间后,测得H2的浓度为0.5mol•L-1,则此时该反应v(正)________v(逆)(填“>”、“<”或“=”);
②若反应温度不变,达到平衡后,H2O的转化率为________。
(3)某实验小组设计了如右图7所示的甲醇燃料电池装置。
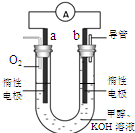
①该电池工作时,OH— 向________________极移动(填“a”或“b”);
②工作一段时间后,测得溶液的pH减小,该电池负极反应的离子方程式为________。
-
Ⅰ.甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。
(1)工业生产甲醇的常用方法是CO(g)+2H2(g)===CH3OH(g) ΔH=-90.8 kJ·mol-1。已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1,H2(g)+1/2O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1。
①H2的燃烧热ΔH=___________kJ·mol-1。
②CH3OH(g)+O2(g)=CO(g)+2H2O(g)的反应热ΔH=________________。
(2)工业上利用甲醇制备氢气常用方法之一是甲醇蒸气重整法。该法中的一个主要反应为CH3OH(g)=CO(g)+2H2(g),此反应能自发进行的原因是______________。
Ⅱ.铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42-2PbSO4+2H2O。请回答下列问题(不考虑氢、氧的氧化还原):
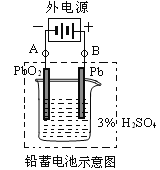
(1)放电时:正极的电极反应式是________________;当外电路通过1 mol电子时,理论上正极板的质量增加___g。
(2)在完全放电耗尽PbO2和Pb时,若按图连接,电解一段时间后,则在A电极上生成___、B电极上生成____。
-
(15分)甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。
⑴工业生产甲醇的常用方法是:CO(g)+2H2(g) CH3OH(g) △H=-90.8 kJ/mol。
CH3OH(g) △H=-90.8 kJ/mol。
已知:2H2(g)+ O2(g)= 2H2O (l) △H=-571.6 kJ/mol
H2(g) + O2(g) = H2O(g) △H=-241.8 kJ/mol
O2(g) = H2O(g) △H=-241.8 kJ/mol
①H2的燃烧热为________▲________kJ/mol。
②CH3OH(g)+O2(g) CO(g)+2H2O(g)的反应热△H=________▲________。
CO(g)+2H2O(g)的反应热△H=________▲________。
③若在恒温恒容的容器内进行反应CO(g)+2H2(g) CH3OH(g),则可用来判断该反应达到平衡状态的标志有________▲________。(填字母)
CH3OH(g),则可用来判断该反应达到平衡状态的标志有________▲________。(填字母)
A.CO百分含量保持不变
B.容器中H2浓度与CO浓度相等
C.容器中混合气体的密度保持不变
D.CO的生成速率与CH3OH的生成速率相等
⑵工业上利用甲醇制备氢气的常用方法有两种:
①甲醇蒸汽重整法。该法中的一个主要反应为CH3OH(g) CO(g)+2H2(g),此反应能自发进行的原因是________▲________。
CO(g)+2H2(g),此反应能自发进行的原因是________▲________。
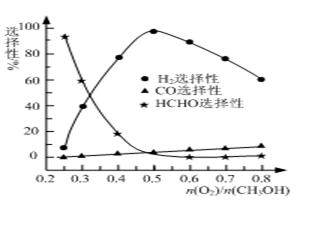
②甲醇部分氧化法。在一定温度下以Ag/CeO2—ZnO为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图所示。则当n(O2)/n(CH3OH)=0.25时,CH3OH与O2发生的主要反应方程式为________▲________;在制备H2时最好控制n(O2)/n(CH3OH)=________▲________。
⑶在稀硫酸介质中,甲醇燃料电池负极发生的电极反应式为________▲________。
-
Ⅰ.甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。
(1)工业生产甲醇的常用方法是CO(g)+2H2(g)===CH3OH(g) ΔH=-90.8 kJ·mol-1。
已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
H2(g)+1/2O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
①H2的燃烧热ΔH=___________kJ·mol-1。
②CH3OH(g)+O2(g)===CO(g)+2H2O(g)的反应热ΔH=________________。
(2)工业上利用甲醇制备氢气常用方法之一是甲醇蒸气重整法。该法中的一个主要反应为CH3OH(g)===CO(g)+2H2(g),此反应能自发进行的原因是____________________________。
Ⅱ.铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是________________;当外电路通过1 mol电子时,理论上负极板的质量增加________g。
(2)在完全放电耗尽PbO2和Pb时,若按图连接,电解一段时间后,则在A电极上生成________、B电极上生成________。

-
Ⅰ.甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2 加氢合成甲醇是合理利用CO2的有效途径。由CO2制备甲醇的过程可能涉及反应如下:
反应Ⅰ:CO2(g)+H2(g)  CO (g)+H2O(g) ΔH
CO (g)+H2O(g) ΔH
 1=41.19 kJ·mol-1
1=41.19 kJ·mol-1
反应Ⅱ:CO(g)+2H2(g)  CH3OH(g) ΔH2
CH3OH(g) ΔH2
反应Ⅲ:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)ΔH3=-49.58 kJ·mol-1
CH3OH(g)+H2O(g)ΔH3=-49.58 kJ·mol-1
回答下列问题:
(1)反应Ⅲ的ΔS________(填“<”“=”或“>”)0;反应Ⅱ的ΔH2=__________________。
(2)在恒压密闭容器中,充入一定量的H2和CO2(假定仅发生反应Ⅲ),实验测得反应物在不同温度下,反应体系中CO2的平衡转化率与压强的关系曲线如图1所示。

反应过程中,不能判断反应Ⅲ已达到平衡状态的标志是________(填字母)。
A.断裂3 mol H—H键,同时生成2 mol H—O键
B.CH3OH的浓度不再改变
C.容器中气体的平均摩尔质量不变
D.容器中气体的压强不变
Ⅱ.电化学原理在化学工业中有广泛的应用。请根据下图回答问题:


(3)根据图2,若装置B中a 为Ag棒,b为铜棒,W为AgNO3溶液,工作一段时间后发现铜棒增重2.16 g,则流经电路的电子的物质的量为____________。
为Ag棒,b为铜棒,W为AgNO3溶液,工作一段时间后发现铜棒增重2.16 g,则流经电路的电子的物质的量为____________。
(4)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含N H4F等的无水熔融物生产NF3,其电解原理如图3所示。写出a电极的电极反应式:_____________________。
H4F等的无水熔融物生产NF3,其电解原理如图3所示。写出a电极的电极反应式:_____________________。
-
甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2 加氢合成甲醇是合理利用CO2的有效途径。由CO2制备甲醇过程可能涉及反应如下:
反应Ⅰ:CO2(g)+ H2(g) CO (g)+H2O(g) △H1=+41.19kJ•mol-1
CO (g)+H2O(g) △H1=+41.19kJ•mol-1
反应Ⅱ:CO(g)+2H2(g) CH3OH(g) △H 2
CH3OH(g) △H 2
反应Ⅲ:CO2(g)+3H2(g) CH3OH(g) +H2O(g) △H3=-49.58kJ•mol-1
CH3OH(g) +H2O(g) △H3=-49.58kJ•mol-1
回答下列问题:
(1)反应Ⅲ的△S (填“<”、“=”或“>”)0;反应Ⅱ的△H2= 。
(2)在恒压密闭容器中,充入一定量的H2和CO2(假定仅发生反应Ⅲ),实验测得反应物在不同温度下,反应体系中CO2的平衡转化率与压强的关系曲线如图1所示。
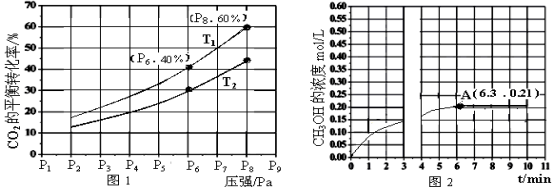
①反应过程中,不能判断反应Ⅲ已达到平衡状态的标志是
A.断裂3molH-H键,同时断裂2molH-O键 B.CH3OH的浓度不再改变
C.容器中气体的平均摩尔质量不变 D.容器中气体的压强不变
②比较T1与T2的大小关系:T1 T2(填“<”、“=”或“>”),理由是: 。
③在T1和P6的条件下,往密闭容器中充入3mol H2和1mol CO2,该反应在第5min时达到平衡,此时容器的体积为1.8L;则该反应在此温度下的平衡常数为 。
a.若此条件下反应至3min时刻,改变条件并于A点处达到平衡,CH3OH的浓度随反应时间的变化趋势如图2所示(3~4min的浓度变化未表示出来);则改变的条件为 。
b.若温度不变,压强恒定在P8的条件下重新达到平衡时,容器的体积变为 L;
-
甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2 加氢合成甲醇是合理利用 CO2 的有效途径.由 CO2 制备甲醇过程可能涉及反应如下:
反应Ⅰ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H1=﹣49.58kJ•mol﹣1
反应Ⅱ:CO2(g)+H2(g)⇌CO (g)+H2O(g)△H2
反应Ⅲ:CO(g)+2H2(g)⇌CH3OH(g)△H3=﹣90.77kJ•mol﹣1,回答下列问题:
(1)反应Ⅱ的△H2= ,反应 I 自发进行条件是 (填“较低温”、“较高温”或“任何温度”).
(2)在一定条件下 3L 恒容密闭容器中,充入一定量的 H2和 CO2 仅发生反应Ⅰ,实验测得反应物在不同起始投入量下,反应体系中 CO2的平衡转化率与温度的关系曲线,如图 1 所示.
①H2和 CO2的起始的投入量以 A 和 B 两种方式投入
A:n(H2)=3mol,n(CO2)=1.5mol
B:n(H2)=3mol,n(CO2)=2mol,曲线 I 代表哪种投入方式 (用 A、B 表示)
②在温度为 500K 的条件下,按照 A 方式充入 3mol H2 和 1.5mol CO2,该反应 10min 时达到平衡:
a.此温度下的平衡常数为 ;500K 时,若在此容器中开始充入 0.3molH2和 0.9mol CO2、0.6molCH3OH、xmolH2O,若使反应在开始时正向进行,则 x 应满足的条件是 .
b.在此条件下,系统中 CH3OH 的浓度随反应时间的变化趋势如图 2 所示,当反应时间达到 3min时,迅速将体系温度升至 600K,请在图2中画出 3~10min 内容器中 CH3OH 浓度的变化趋势曲线.
(3)固体氧化物燃料电池是一种新型的燃料电池,它是以固体氧化锆氧化钇为电解质,这种固体 电解质在高温下允许氧离子(O2﹣)在其间通过,该电池的工作原理如图 3 所示,其中多孔电极均 不参与电极反应,图3是甲醇燃料电池的模型.
①写出该燃料电池的负极反应式 .
②如果用该电池作为电解装置,当有 16g 甲醇发生反应时,则理论上提供的电量最多为 mol.
CH3OH(g)+H2O(g) △H1=-49.0kJ/mol
CO(g)+H2O(g) △H2
CH3OH(g) △H3=-90.0kJ/mol
C3H6(g)+3H2O(g) △H4=-31.0kJ/mol















