-
甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。
(1)工业生产甲醇的常用方法是:CO(g)+2H2(g)  CH3OH(g) △H = —90.8kJ/mol。
CH3OH(g) △H = —90.8kJ/mol。
已知:2H2(g)+O2(g)=2H2O(l) △H = —571.6kJ/mol;
H2(g)+ O2(g)=H2O(g) △H = —241.8kJ/mol;
O2(g)=H2O(g) △H = —241.8kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H = —566.0kJ/mol
CH3OH(g) = CH3OH(l) △H = —37.3kJ/mol
①计算液体CH3OH的燃烧热为________________________。
②若在恒温恒容的容器内进行反应CO(g)+2H2(g)  CH3OH(g),下列表示该反应达到平衡状态的标志有________________________(填字母序号)。
CH3OH(g),下列表示该反应达到平衡状态的标志有________________________(填字母序号)。
A.有1个H—H键生成的同时有 3个C—H键生成
B.CO百分含量保持不变
C.容器中混合气体的压强不变化
D.容器中混合气体的密度不变化
(2)制甲醇所需要的H2,可用下列反应制取:H2O(g)+CO(g)  H2(g)+ CO2(g) △H<0,某温度下该反应的平衡常数K=1。若起始时c(CO)=1mol•L-1,c(H2O)=2mol•L-1,试回答下列问题:
H2(g)+ CO2(g) △H<0,某温度下该反应的平衡常数K=1。若起始时c(CO)=1mol•L-1,c(H2O)=2mol•L-1,试回答下列问题:
①该温度下,反应进行一阶段时间后,测得H2的浓度为0.5mol•L-1,则此时该反应v(正)________v(逆)(填“>”、“<”或“=”);
②若反应温度不变,达到平衡后,H2O的转化率为________。
(3)某实验小组设计了如右图7所示的甲醇燃料电池装置。
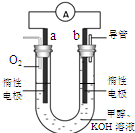
①该电池工作时,OH— 向________________极移动(填“a”或“b”);
②工作一段时间后,测得溶液的pH减小,该电池负极反应的离子方程式为________。
-
Ⅰ.甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。
(1)工业生产甲醇的常用方法是CO(g)+2H2(g)===CH3OH(g) ΔH=-90.8 kJ·mol-1。已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1,H2(g)+1/2O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1。
①H2的燃烧热ΔH=___________kJ·mol-1。
②CH3OH(g)+O2(g)=CO(g)+2H2O(g)的反应热ΔH=________________。
(2)工业上利用甲醇制备氢气常用方法之一是甲醇蒸气重整法。该法中的一个主要反应为CH3OH(g)=CO(g)+2H2(g),此反应能自发进行的原因是______________。
Ⅱ.铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42-2PbSO4+2H2O。请回答下列问题(不考虑氢、氧的氧化还原):
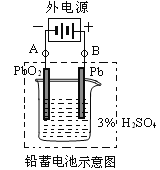
(1)放电时:正极的电极反应式是________________;当外电路通过1 mol电子时,理论上正极板的质量增加___g。
(2)在完全放电耗尽PbO2和Pb时,若按图连接,电解一段时间后,则在A电极上生成___、B电极上生成____。
-
(15分)甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。
⑴工业生产甲醇的常用方法是:CO(g)+2H2(g) CH3OH(g) △H=-90.8 kJ/mol。
CH3OH(g) △H=-90.8 kJ/mol。
已知:2H2(g)+ O2(g)= 2H2O (l) △H=-571.6 kJ/mol
H2(g) + O2(g) = H2O(g) △H=-241.8 kJ/mol
O2(g) = H2O(g) △H=-241.8 kJ/mol
①H2的燃烧热为________▲________kJ/mol。
②CH3OH(g)+O2(g) CO(g)+2H2O(g)的反应热△H=________▲________。
CO(g)+2H2O(g)的反应热△H=________▲________。
③若在恒温恒容的容器内进行反应CO(g)+2H2(g) CH3OH(g),则可用来判断该反应达到平衡状态的标志有________▲________。(填字母)
CH3OH(g),则可用来判断该反应达到平衡状态的标志有________▲________。(填字母)
A.CO百分含量保持不变
B.容器中H2浓度与CO浓度相等
C.容器中混合气体的密度保持不变
D.CO的生成速率与CH3OH的生成速率相等
⑵工业上利用甲醇制备氢气的常用方法有两种:
①甲醇蒸汽重整法。该法中的一个主要反应为CH3OH(g) CO(g)+2H2(g),此反应能自发进行的原因是________▲________。
CO(g)+2H2(g),此反应能自发进行的原因是________▲________。
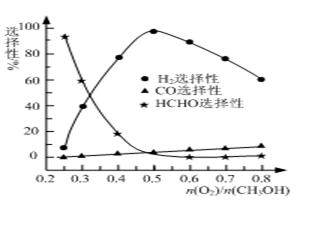
②甲醇部分氧化法。在一定温度下以Ag/CeO2—ZnO为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图所示。则当n(O2)/n(CH3OH)=0.25时,CH3OH与O2发生的主要反应方程式为________▲________;在制备H2时最好控制n(O2)/n(CH3OH)=________▲________。
⑶在稀硫酸介质中,甲醇燃料电池负极发生的电极反应式为________▲________。
-
Ⅰ.甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。
(1)工业生产甲醇的常用方法是CO(g)+2H2(g)===CH3OH(g) ΔH=-90.8 kJ·mol-1。
已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
H2(g)+1/2O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
①H2的燃烧热ΔH=___________kJ·mol-1。
②CH3OH(g)+O2(g)===CO(g)+2H2O(g)的反应热ΔH=________________。
(2)工业上利用甲醇制备氢气常用方法之一是甲醇蒸气重整法。该法中的一个主要反应为CH3OH(g)===CO(g)+2H2(g),此反应能自发进行的原因是____________________________。
Ⅱ.铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是________________;当外电路通过1 mol电子时,理论上负极板的质量增加________g。
(2)在完全放电耗尽PbO2和Pb时,若按图连接,电解一段时间后,则在A电极上生成________、B电极上生成________。

-
甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。
I.用CO2生产甲醇、乙醇
(1)已知:H2的燃烧热为-285.8 kJ/mol,CH3OH(l)的燃烧热为-725.8kJ/mol,CH3OH(g)=CH3OH(l) △H= -37.3 kJ/mol,则CO2(g)+3H2(g)=CH3OH(g)+ H2O(1) △H=____kJ/mol。
(2)将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应[生成 H2O(g)],如图1表示压强为0.1 MPa和5.0 MPa下CO2转化率随温度的变化关系。
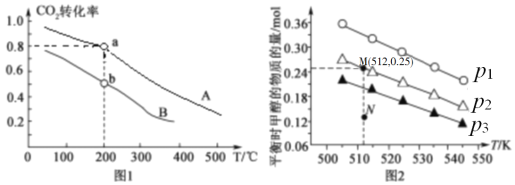
①a、b两点化学反应速率分别用Va、Vb,表示,则Va ___Vb(填“大于”、“小于”或“等于”)。
②列出a点对应的平衡常数表达式K= ____________________。
(3)在1.0 L恒容密闭容器中投入1 mol CO2和2.75 mol H2发生反应:CO2(g)+3H2(g)  CH3OH (g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是_____。
CH3OH (g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是_____。
A.该反应的正反应为放热反应
B.压强大小关系为p1<p2<p3
C.M点对应的平衡常数K的值约为1.04×10-2
D.在p2及512 K时,图中N点υ(正)<υ(逆)
(4)CO2催化加氢合成乙醇的反应为:2CO2(g)+6H2(g)  C2H5OH(g) +3H2O(g) △H;m代表起始时的投料比,即m=
C2H5OH(g) +3H2O(g) △H;m代表起始时的投料比,即m=
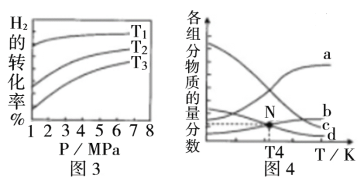
①图3中投料比相同,温度T3>T2>T1,则该反应的焓变△H____0(填“>”、“<”)。
②m=3时,该反应达到平衡状态后p(总)=20a MPa,恒压条件下各物质的物质的量分数与温度的关系如图4所示,则曲线b代表的物质为_________(填化学式),T4温度时,反应达到平衡时物质d的分压p(d)=___________。
Ⅱ.甲醇的应用
(5)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图5所示。
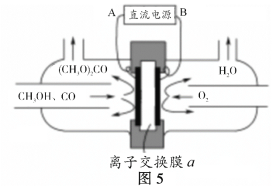
离子交换膜a为_____(填“阳膜”、“阴膜”),阳极的电极反应式为______________。
-
甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。
Ⅰ.用CO2生产甲醇
(1)已知:H2的燃烧热为-285.8kJ/mol,CH3OH(l)的燃烧热为-725.8kJ/mol,
CH3OH(g)=CH3OH(l) ΔH=-37.3kJ/mol
则CO2(g)+3H2(g) CH3OH(g)+H2O(l)ΔH=__kJ/mol。
CH3OH(g)+H2O(l)ΔH=__kJ/mol。
(2)将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应,如图1两条曲线分别表示压强为0.1MPa和5.0MPa下CO2转化率随温度的变化关系。
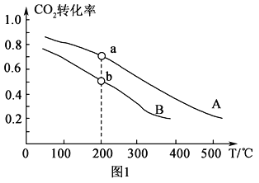
其中a点的平衡常数表达式为:__。
②a,b两点化学反应速率分别用Va、Vb表示,则Va__Vb(填“大于”、“小于”或“等于”)。
(3)在1.0L恒容密闭容器中投入1molCO2和2.75molH2发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是__。
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是__。
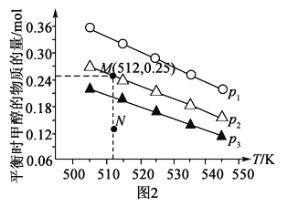
A.该反应的正反应为放热反应
B.压强大小关系为p1<p2<p3
C.M点对应的平衡常数K的值约为1.04×10-2
D.在p2及512K时,图中N点v(正)<v(逆)
Ⅱ.用CO生产甲醇
(4)已知:CO(g)+2H2(g) CH3OH(g),如图3是该反应在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g),如图3是该反应在不同温度下CO的转化率随时间变化的曲线。
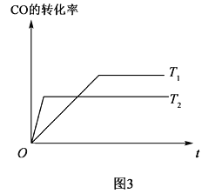
①该反应的焓变ΔH__0(填“ ”、“ ”或“ ”)。
②T1和T2温度下的平衡常数大小关系是K1___K2(填“>”、“<”或“=”)。
Ⅲ.甲醇的应用
(5)甲醇制氢气。甲醇水蒸气重整制氢反应:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49kJ/mol。某温度下,将[n(H2O):n(CH3OH)]=1:1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为___。
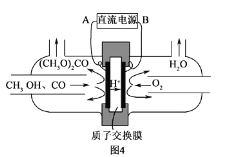
(6)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图4所示。阳极的电极反应式为__。
-
甲醇是一种重要的化工原料,有着重要的用途和应用前景。请回答下列问题:
(1)工业生产甲醇的常用方法是CO(g)+2H2(g) CH3OH(g) ΔH=-90.8 kJ·mol-1。
CH3OH(g) ΔH=-90.8 kJ·mol-1。
已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1;
H2(g)+ O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1;
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1;
2CO(g)+O2(g)===2CO2(g) ΔH=-566.0 kJ·mol-1;
CH3OH(g)===CH3OH(l) ΔH=-37.3 kJ·mol-1。
计算液体CH3OH的燃烧热为 。
(2)污水中的含氮化合物,通常先用生物膜脱氮工艺进行处理,在硝化细菌的作用下将NH 氧化为
氧化为
NO (2NH4++3O2=2HNO2+2H2O +2H+;2HNO2 +O2=2HNO3)。然后加入甲醇,甲醇和NO
(2NH4++3O2=2HNO2+2H2O +2H+;2HNO2 +O2=2HNO3)。然后加入甲醇,甲醇和NO 反应转化为两种无毒气体。写出加入甲醇后反应的离子方程式: 。
反应转化为两种无毒气体。写出加入甲醇后反应的离子方程式: 。
(3)甲醇不完全燃烧产生的CO可利用I2O5来除去,其反应为5CO(g)+I2O5(s) 5CO2(g) +I2(s)。不
5CO2(g) +I2(s)。不
同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得的CO2体积分数随着时间
t变化曲线如图所示。则:
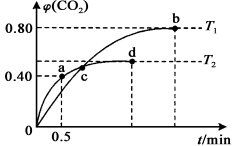
①T2温度时,0~0.5 min的反应速率v(CO)= 。
②T1温度时,反应达到平衡,CO的转化率为 ,化学平衡常数K= (用具体数值表示)。
③下列说法正确的是 (填编号)。
A.容器内压强不变,表明反应达到平衡状态
B.容器内气体密度不变,表明反应达到平衡状态
C.单位时间内,消耗a mol CO,同时消耗2a mol CO2, 表明反应v(正)<v(逆)
D.两种温度下,c点时体系中混合气体的压强相等
E.反应5CO(g)+I2O5(s) 5CO2(g)+I2(s)为吸热反应
5CO2(g)+I2(s)为吸热反应
(4)将500 mL(标准状况)甲醇不完全燃烧产生的气体样品通过盛有足量I2O5的干燥管,170 ℃下充分反应,用水—乙醇液充分溶解产物I2,定容到100 mL。取25.00 mL,用0.0100 mol·L-1 Na2S2O3标准溶液滴定,消耗标准溶液20.00 mL,则样品气中CO的体积分数为 。(已知:气体样品中其他成分与I2O5不反应;2Na2S2O3+I2=2NaI+Na2S4O6)
-
(15分)甲醇来源丰富,价格低廉,是一种重要的化工原料,有着非常重要、广泛的用途。工业上通常用水煤气在恒容、催化剂和加热的条件下生产甲醇,其热化学方程式为:
2H2(g)+CO(g) CH3OH(g) ΔH=-90.8kJ/mol。
CH3OH(g) ΔH=-90.8kJ/mol。
(1)该反应的平衡常数表达式为:K= ,如升高温度,K值将 (填:增大、减小或不变)。
(2)以下各项不能说明该反应达到平衡状态的是 .
A、混合气体的密度保持不变 B、甲醇的质量分数保持不变
C、CO的浓度保持不变 D、2v逆(H2)=v正(CH3OH)
(3)在2100C、2400C和2700C三种不同温度、2 L恒容密闭容器中研究合成甲醇的规律。
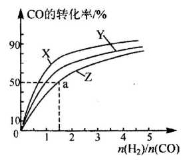
上图是上述三种温度下不同的H2和C0的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线Z对应的温度是 。由起始达到a点所需时间为5min,则H2的反应速率 mol/(L·min)。
(4)某兴趣小组设计了如图所示的甲醇燃料电池装置。
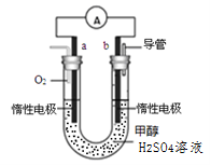
①该电池工作时,正极是 极(填“a”或 “b”);
②该电池负极反应的离子方程式为 。
-
甲醇是一种重要的化工原料,有着重要的用途和应用前景。
(1)工业上常用CO和H2合成甲醇:CO(g)+2H2(g)  CH3OH(g) △H
CH3OH(g) △H
①已知:aA(g)+bB(g)=xX(g)+yY(g) △H=x△Hm[X(g)]+y△Hm[Y(g)]-a△Hm[A(g)]-b△Hm[B(g)]。
△Hm[X(g)]表示X(g)的摩尔生成焓,其余类推。25℃101kPa时,CO(g)、H2(g)、CH3OH(g)的摩尔生成焓分别为-110.5kJ·mol-1、0、-201.2kJ·mol-1,则上述反应的△H=_____。
②某温度下,向容积为2L的密闭容器中加入1molCO和2molH2,发生上述反应,CO转化率随时间的变化如图所示:
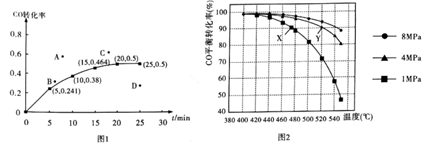
该温度下反应的平衡常数为_______;若起始压强为9MPa,则10min时容器中的压强为_______;若保持其它条件不变,起始时加入2molCO和2molH2,达到平衡,相应的点可能是上图A、B、C、D中的____。
③若只改变反应的一个条件,能使平衡体系中 增大的措施有_______________(答出两点即可)。
增大的措施有_______________(答出两点即可)。
④若投料时CO与H2的物质的量之比恒定,温度、压强对CO平衡转化率的影响如图所示,如图中X点的v(逆)____________Y点的v(正)(填“>”“<”或“=”),理由是_____________。
(2)工业上常用CH3OH来制备HCOOH(甲酸)。已知25℃时,0.1mol·L-1HCOOH溶液的pH为2.3,则甲酸的电离度计算式为______;向0.1mol·L-1HCOOH溶液中加水或加入少量HCOONa晶体时,会引起同样变化的是_______(填编号)。
A.溶液的pH增大 B.HCOOH的电离程度增大
C.溶液的导电能力减弱 D.溶液中c(OH-)减小
-
甲醇是一种重要的化工原料,有着重要的用途和应用前景。
(1)工业上常用CO和H2合成甲醇:CO(g)+2H2(g)  CH3OH(g) △H
CH3OH(g) △H
①已知:aA(g)+bB(g)=xX(g)+yY(g) △H=x△Hm[X(g)]+y△Hm[Y(g)]-a△Hm[A(g)]-b△Hm[B(g)]。
△Hm[X(g)]表示X(g)的摩尔生成焓,其余类推。25℃101kPa时,CO(g)、H2(g)、CH3OH(g)的摩尔生成焓分别为-110.5kJ·mol-1、0、-201.2kJ·mol-1,则上述反应的△H=_____。
②某温度下,向容积为2L的密闭容器中加入1molCO和2molH2,发生上述反应,CO转化率随时间的变化如图所示:
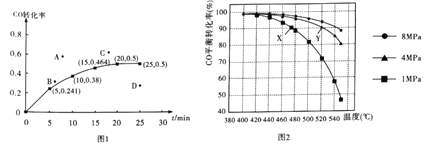
该温度下反应的平衡常数为_______;若起始压强为9MPa,则10min时容器中的压强为_______;若保持其它条件不变,起始时加入2molCO和2molH2,达到平衡,相应的点可能是上图A、B、C、D中的____。
③若只改变反应的一个条件,能使平衡体系中 增大的措施有_______________(答出两点即可)。
增大的措施有_______________(答出两点即可)。
④若投料时CO与H2的物质的量之比恒定,温度、压强对CO平衡转化率的影响如图所示,如图中X点的v(逆)____________Y点的v(正)(填“>”“<”或“=”),理由是_____________。
(2)工业上常用CH3OH来制备HCOOH(甲酸)。已知25℃时,0.1mol·L-1HCOOH溶液的pH为2.3,则甲酸的电离度计算式为______;向0.1mol·L-1HCOOH溶液中加水或加入少量HCOONa晶体时,会引起同样变化的是_______(填编号)。
A.溶液的pH增大 B.HCOOH的电离程度增大
C.溶液的导电能力减弱 D.溶液中c(OH-)减小
CH3OH(g)+H2O(l)ΔH=__kJ/mol。

CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是__。

CH3OH(g),如图3是该反应在不同温度下CO的转化率随时间变化的曲线。












