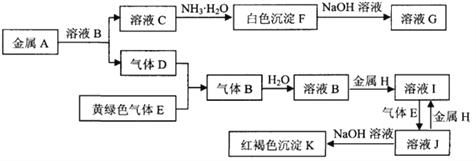
-
化学在日常生活中有着广泛的应用。下列说法不正确的是
A. 明矾可用于水的杀菌消毒
B. 炒菜时加碘食盐最好最后放
C. 雾霾天气中可以产生丁达尔现象
D. 燃料的脱硫和脱氮都是减少酸雨产生的措施
难度: 简单查看答案及解析
-
下列实验操作中错误的是
A. 用规格为10 mL的量筒量取6.0 mL的液体
B. 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C. 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D. 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
难度: 中等查看答案及解析
-
下列关于纯净物、混合物、电解质和非电解质的正确组合是
纯净物
混合物
电解质
非电解质
A
盐酸
水煤气
硫酸
干冰
B
冰醋酸
空气
硫酸钡
二氧化硫
C
氯气
盐酸
苛性钠
碳酸钙
D
漂白粉
氨水
氯化钠
氯气
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
工业上曾经通过反应“3Fe+4NaOH= Fe3O4+2H2↑+4Na↑”生产金属钠.下列有关说法正确的是
A. 用磁铁可以将Fe与Fe3O4分离 B. 将生成的气体在空气中冷却可获得钠
C. 该反应中的氧化剂NaOH D. 每生成22.4LH2,转移的电子数一定为4×6.02×1023
难度: 困难查看答案及解析
-
有些科学家提出硅是“21世纪的能源”,下列有关硅及其化合物的说法正确的是
A. 硅在自然界中以游离态和化合态两种形式存在
B. 硅晶体是良好的半导体,可用于制造光导纤维
C. SiO2是酸性氧化物,不与任何酸发生反应
D. 木材浸过水玻璃后,不易着火
难度: 简单查看答案及解析
-
下列仪器不能用来作反应容器的是( )
A. 试管 B. 烧杯 C. 量筒 D. 锥形瓶
难度: 简单查看答案及解析
-
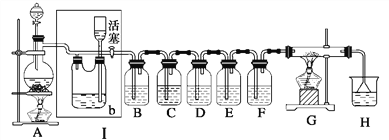
下列能达到实验目的的是( )
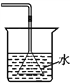


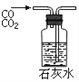
A. 吸收HCl防倒吸 B. 制取少量蒸馏水 C. 转移溶液 D. 除去杂质气体CO2
难度: 中等查看答案及解析
-
为除去 括号内的杂质,所选用的试剂或方法不正确的是
A.Na2CO3溶液(NaHCO3),选用适量NaOH溶液
B.NaHCO3溶液(Na2CO3),通入过量的CO2气体
C.Na2O2粉末(Na2O),将混合物在氧气中加热
D.CO2气体(CO),通入O2点燃
难度: 简单查看答案及解析
-
既能与盐酸反应,又能与NaOH溶液反应的是
①SiO2②Al(OH)3③NaHCO3④Al2O3⑤Na2CO3
A. 全部 B. ①②④ C. ②④⑤ D. ②③④
难度: 中等查看答案及解析
-
既能与盐酸反应,又能与NaOH溶液反应的是
①SiO2②Al(OH)3③NaHCO3④Al2O3⑤Na2CO3
A. 全部 B. ①②④ C. ②④⑤ D. ②③④
【答案】D
【解析】试题分析:①二氧化硅不能盐酸反应,但能和NaOH反应生成硅酸钠,故①错误;②氢氧化铝属于两性氢氧化物,既能与强酸反应也能与强碱反应,故②正确;③碳酸氢钠是弱酸的酸式盐,所以既能与强酸反应也能与强碱反应,故③正确;④氧化铝是两性氢氧化物,既能与强酸反应也能与强碱反应,故④正确;⑤碳酸钠是弱酸的正盐,所以能与强酸反应,但不能与强碱反应,故⑤错误;正确的有②③④,故选D。
【考点定位】考查元素及其化合物的性质
【名师点晴】本题考查元素化合物的性质。旨在考查学生对知识的理解识记与知识归纳,注意基础知识的积累,根据物质间的反应进行判断,中学常见的既能与酸反应又能与碱反应的物质主要有:①两性物质:Al2O3、ZnO、Al(OH)3、Zn(OH)2、氨基酸、蛋白质等;②多元弱酸的酸式盐:NaHCO3、KHS、KHSO3、NaH2PO4等;③弱酸的铵盐及其酸式盐:(NH4)2S、NH4HS、(NH4)2CO3、NH4HCO3、CH3COONH4等;④某些具有两性的金属:Zn、Al等;⑤某些非金属:Si、S等;⑥其它一些物质。如:a、某些盐类物质既与酸反应,又与碱反应;b、个别酸性氧化物SiO2;c、具有还原性的无氧酸:H2S、HI等与氧化性酸反应、与碱反应;d、具有氧化性酸:浓H2SO4、HNO3等与还原性酸反应、与碱反应。
【题型】单选题
【结束】
10现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质碘的水溶液,分离以上各混合液的正确方法依次是( )
A. 分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C. 分液、蒸馏、萃取 D. 蒸馏、萃取、分液
难度: 简单查看答案及解析
-
现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质碘的水溶液,分离以上各混合液的正确方法依次是( )
A. 分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C. 分液、蒸馏、萃取 D. 蒸馏、萃取、分液
【答案】C
【解析】①汽油不溶于水,分离汽油和氯化钠溶液需要分液;②乙醇与水互溶,但与水的沸点相差较大,分离39%的乙醇溶液需要蒸馏;③单质碘易溶在有机溶剂中,分离碘的水溶液需要萃取,答案选C。
【题型】单选题
【结束】
11光导纤维的主要原料是( )
A. 硅 B. 二氧化硅 C. 碳化硅 D. 硅酸钠
难度: 简单查看答案及解析
-
光导纤维的主要原料是( )
A. 硅 B. 二氧化硅 C. 碳化硅 D. 硅酸钠
【答案】B
【解析】光导纤维的主要原料是二氧化硅,答案选B。
【题型】单选题
【结束】
12下列有关氯气的叙述正确的是( )
A. 氯气是一种黄绿色、有毒的气体
B. 氯气在自然界既有化合态也有游离态
C. 实验室一般用排水法收集氯气
D. 氯气和液氯是状态不同的两种物质
难度: 简单查看答案及解析
-
下列有关氯气的叙述正确的是( )
A. 氯气是一种黄绿色、有毒的气体
B. 氯气在自然界既有化合态也有游离态
C. 实验室一般用排水法收集氯气
D. 氯气和液氯是状态不同的两种物质
【答案】A
【解析】A. 氯气是一种黄绿色、有毒的气体,A正确;B. 氯气是单质,元素在自然界中的存在才分为化合态和游离态,例如氯元素在自然界中全部以化合态的形式存在,B错误;C. 氯气能溶于水,密度大于空气,实验室一般用排饱和食盐水法或向上排空气法收集氯气,C错误;D. 氯气和液氯是状态不同的同一种物质,D错误,答案选A。
【题型】单选题
【结束】
13在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液 体积的关系如图所示,由此确定,原溶液中含有的阳离子是( )

A. Mg2+、Al3+、Fe2+ B. H+、Mg2+、Al3+
C. H+、Ba2+、Al3+ D. 只有Mg2+、Al3+
难度: 简单查看答案及解析
-
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液 体积的关系如图所示,由此确定,原溶液中含有的阳离子是( )

A. Mg2+、Al3+、Fe2+ B. H+、Mg2+、Al3+
C. H+、Ba2+、Al3+ D. 只有Mg2+、Al3+
【答案】B
【解析】根据图像,可以看出分为4个阶段:第一阶段无沉淀,第二阶段沉淀量逐渐增多到最大量,第三阶段有部分沉淀能和氢氧化钠继续反应,即部分沉淀溶解,第四阶段沉淀的量不再随着氢氧化钠量的增多而增加。第一阶段无沉淀,说明水溶液中一定含有氢离子,故AD错误,第三阶段有部分沉淀能和氢氧化钠继续反应,说明部分沉淀是氢氧化铝,原溶液中一定含有铝离子,第四阶段沉淀的量不再随着氢氧化钠量的增多而增加,说明一定有一种沉淀和氢氧化钠不反应,可推知该沉淀是氢氧化镁,原溶液中一定含有镁离子,铜离子有颜色,与溶液无色不符,故B正确,C错误;故选B。
【题型】单选题
【结束】
14将适量铁粉放入FeCl3溶液中,完全反应后,溶液中的Fe2+和Fe3+浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是( )
A. 2∶3 B. 3∶2
C. 1∶2 D. 1∶1
难度: 简单查看答案及解析
-
将适量铁粉放入FeCl3溶液中,完全反应后,溶液中的Fe2+和Fe3+浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是( )
A. 2∶3 B. 3∶2
C. 1∶2 D. 1∶1
【答案】A
【解析】将适量铁粉放入FeCl3溶液中,完全反应,发生的反应为:Fe+2Fe3+=3Fe2+,已反应的Fe3+的物质的量为x,则
Fe+2Fe3+=3Fe2+
2 3
x 1.5x
溶液中的Fe3+和Fe2+浓度相等,所以,未反应的Fe3+的物质的量为1.5x,所以已反应的Fe3+和未反应的Fe3+的物质的量之比=x:1.5x=2:3,故选A。
【题型】单选题
【结束】
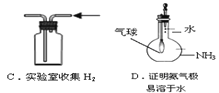
15下列实验装置图所示的实验操作,不能达到相应实验目的的是( )
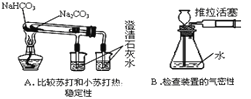
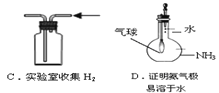
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列实验装置图所示的实验操作,不能达到相应实验目的的是( )
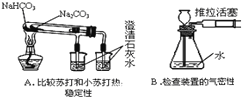
A. A B. B C. C D. D
【答案】A
【解析】A、应该把易分解的碳酸氢钠放在里面的小试管中,A错误;B、拉注射器使瓶内压强减小,长颈漏斗末端会有气泡冒出,据此可以判断装置是否漏气,B正确;C、氢气密度小于空气,可以用向下排空气法收集,C正确;D、滴入水后氨气溶于水,压强减小,气球会膨胀,据此可以证明氨气易溶于水,D正确,答案选A。
点睛:本考点考查的是实验方案设计与评价,化学实验识图题是考试中的热点内容,明确物质的性质和实验原理是解答的关键,该题中气密性检验是解答的难点。主要是难在以下两点:一是方法,二是文字表述。其叙述形式是:装置形成封闭体系→操作(微热、手捂、热毛巾捂、加水等)→描述现象→得出结论;①微热法检查的关键词是封闭、微热、气泡、水柱;②液差(封)法的关键词是封闭、液差。例如选项B中推动注射器之后导管中会出现一段液柱,且液面差不改变。
【题型】单选题
【结束】
16在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是( )
A. Na+、K+、OH-、Cl- B. Na+、Cu2+、SO42-、NO3-
C. Ba2+、HCO3-、NO3-、K+ D. Mg2+、Na+、SO42-、Cl-
难度: 简单查看答案及解析
-
在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是( )
A. Na+、K+、OH-、Cl- B. Na+、Cu2+、SO42-、NO3-
C. Ba2+、HCO3-、NO3-、K+ D. Mg2+、Na+、SO42-、Cl-
【答案】D
【解析】A. 酸性溶液中OH-不能大量共存,A错误;B. Cu2+在溶液中显蓝色,不是无色,不能大量共存,B错误;C. 酸性溶液中HCO3-不能大量共存,C错误;D. Mg2+、Na+、SO42-、Cl-在强酸性溶液中不反应,且均是无色的,可以大量共存,D正确,答案选D。
点睛:掌握离子间发生的化学反应是解答的关键,分析离子间能否大量共存时一般可以从以下几个角度去把握:即能否发生复分解反应生成易挥发性物质或难电离物质或难溶性物质、能否生氧化还原反应、能否发生络合反应(中学化学中只需要掌握铁离子与KSCN的反应即可)等。
【题型】单选题
【结束】
17下列各组物质反应后,再滴入KSCN溶液,显红色的是( )
A. CuCl2溶液中加入铁粉 B. 单质Fe与过量稀盐酸反应后的溶液中再加入少量氯水
C. 向FeO中加入稀硫酸 D. Fe(OH)3与过量稀盐酸反应后的溶液中再加入过量铁粉
难度: 中等查看答案及解析
-
下列各组物质反应后,再滴入KSCN溶液,显红色的是( )
A. CuCl2溶液中加入铁粉 B. 单质Fe与过量稀盐酸反应后的溶液中再加入少量氯水
C. 向FeO中加入稀硫酸 D. Fe(OH)3与过量稀盐酸反应后的溶液中再加入过量铁粉
【答案】B
【解析】A.铁和氯化铜溶液反应生成铜和氯化亚铁,溶液中无铁离子,滴入KSCN溶液不显红色,A错误;B.单质Fe与过量稀盐酸反应后生成氯化亚铁和氢气,溶液中再加入少量氯水,氯水氧化氯化亚铁为氯化铁,滴入KSCN溶液显红色,B正确;C.氧化亚铁和硫酸反应生成硫酸亚铁和水,溶液中无铁离子,滴入KSCN溶液不显红色,C错误;D.Fe(OH)3与过量稀盐酸反应生成氯化铁,加入过量铁粉生成氯化亚铁,溶液中无铁离子,滴入KSCN溶液不显红色,D错误;答案选B。
【题型】单选题
【结束】
18下列化学方程式中,不能用H++OH﹣=H2O表示的是( )
A. 2NaOH+H2SO4=Na2SO4+2H2O
B. Ba(OH)2+2HCl=BaCl2+2H2O
C. Cu(OH)2+2HNO3=Cu(NO3)2+2H2O
D. KOH+HCl=KCl+H2O
难度: 中等查看答案及解析
-
下列化学方程式中,不能用H++OH﹣=H2O表示的是( )
A. 2NaOH+H2SO4=Na2SO4+2H2O
B. Ba(OH)2+2HCl=BaCl2+2H2O
C. Cu(OH)2+2HNO3=Cu(NO3)2+2H2O
D. KOH+HCl=KCl+H2O
【答案】C
【解析】A、氢氧化钠是强碱,硫酸是强酸,硫酸钠是可溶性的盐,故A正确;B、氢氧化钡是强碱,盐酸是强酸,氯化钡是可溶性的盐,故B正确;C、氢氧化铜是一种弱碱,其离子反应为Cu(OH)2+2H+=2H2O+Cu2+,故C错误;D、氢氧化钾是强碱,盐酸是强酸,氯化钾是可溶性的盐,故D正确;故选C。
【题型】单选题
【结束】
19下列物质长期露置于空气中会变质,但不是发生氧化还原反应的是( )
A. Na B. 氯水 C. FeSO4 D. NaOH
难度: 简单查看答案及解析
-
下列物质长期露置于空气中会变质,但不是发生氧化还原反应的是( )
A. Na B. 氯水 C. FeSO4 D. NaOH
【答案】D
【解析】A.Na与氧气反应生成氧化钠,反应中钠元素、氧元素的化合价发生变化,属于氧化还原反应,A不符合;B.氯水中含有HClO,不稳定,见光分解生成HCl和O2,发生氧化还原反应,B不符合;C.FeSO4在空气中被氧气氧化而变质,属于氧化还原反应,C不符合;D.在空气中NaOH潮解,与二氧化碳反应生成碳酸钠,没有发生氧化还原反应,D符合;答案选D。
【题型】单选题
【结束】
20等量的铁分别与足量的盐酸、水蒸气在一定的条件下充分反应,则在相同的条件下,产生氢气的体积比是( )
A. 1∶1 B. 4∶3 C. 2∶3 D. 3∶4
难度: 简单查看答案及解析