-
下列说法不正确的是
A
B
C
D
铝制饭盒

聚乙烯盒

铁罐车

带玻璃塞的试剂瓶

不宜长时间存放酸性或碱性的食物
能用于盛放食品
可用于运输浓硫酸
可用于盛放氢氧化钠溶液
难度: 简单查看答案及解析
-
下列有关化学用语使用正确的是
A.硫离子的结构示意图:

B.原子核内有10个中子的氧原子:
O
C.NH4Cl的电子式:
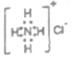
D.乙烯的结构简式C2H4
难度: 简单查看答案及解析
-
有些古文或谚语包含了丰富的化学知识,下列解释不正确的是
选项
古文或谚语
化学解释
A
日照香炉生紫烟
碘的升华
B
以曾青涂铁,铁赤色如铜
置换反应
C
煮豆燃豆萁
化学能转化为热能
D
雷雨肥庄稼
自然固氮
难度: 简单查看答案及解析
-
下表所列物质或概念间的从属关系符合下图所示关系的是
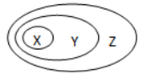
选项
X
Y
Z
A
光导纤维
酸性氧化物
传统无机非金属材料
B
纯碱
碱
化合物
C
电解质
化合物
纯净物
D
H2SO4
含氧酸
强酸
难度: 简单查看答案及解析
-
磷酸(H3PO4)、亚磷酸(H3PO3)和次磷酸(H3PO2)都是重要的化工产品。已知:1mol磷酸、亚磷酸、次磷酸最多消耗NaOH的物质的量依次为3mol、2mol、1mol。下列推断正确的是
A.磷酸与氢氧化钠反应能生成2种盐
B.NaH2PO4、NaH2PO3、NaH2PO2都是酸式盐
C.H3PO4、H3PO3、H3PO2都是含氧酸
D.H3PO3是三元酸,又是还原性酸
难度: 简单查看答案及解析
-
已知某酸性溶液中存在较多的Cu2+、NO3-,则该溶液中还可能大量存在的离子组是
A.OH-、CO32-、Na+ B.SO42-、Cl-、NH4+
C.ClO-、HCO3-、K+ D.Br-、Fe2+、Ba2+
难度: 中等查看答案及解析
-
下列溶液配制实验的描述完全正确的是
A. 在容量瓶中先加入一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸
B. 用浓盐酸配制1:1(体积比)的稀盐酸(约6 mol •L-1)通常需要用容量瓶等仪器
C. 配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4以防水解
D. 用pH =1的盐酸配制100 ml pH=2的盐酸所需全部玻璃仪器有100 ml容量瓶、烧杯、玻璃棒、胶头滴管
难度: 中等查看答案及解析
-
向下列溶液中通入氯气,现象和结论描述正确的是
A.品红溶液:红色褪去,加热该褪色溶液,仍无色;氯气具有漂白性
B.紫色石蕊溶液:先变红,后褪色;氯气与水反应生成盐酸和次氯酸
C.含酚酞的氢氧化钠溶液:红色褪去;氯气只作氧化剂
D.硫化钠溶液:溶液变浑浊;氯气只作还原剂
难度: 中等查看答案及解析
-
在实验室进行教材中重点演示实验,括号内的实验仪器或试剂都能用到的是
A. 验证牺牲阳极的阴极保护法(Fe电极、烧杯、K3[Fe(CN)6]溶液)
B. 铝热反应(漏斗、KClO3、铝粉)
C. 探究温度对化学平衡的影响(温度计、NO2球、烧杯)
D. 制氢氧化铁胶体(饱和FeCl3溶液、玻璃棒、胶头滴管)
难度: 简单查看答案及解析
-
下列药品和装置合理,能完成相应实验的是
A
B
C
D



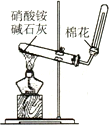
碳酸氢钠受热分解
二氧化碳喷泉式样
乙二酸和乙二醇酯化反应
实验室制氨气
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法正确的是
A.12g石墨和C60的混合物中质子总数为6NA
B.1LpH=1的硫酸溶液中含有的H+数为0.2NA
C.78gNa2O2固体中含有的阴离子数为2NA
D.500ml 2mol·L-1FeCl3溶液中Fe3+数为NA,且
=3
难度: 简单查看答案及解析
-
下列离子方程式中,正确的是
A.向NaOH溶液中加入少量Mg(HCO3)2溶液:2OH-+Mg2+=Mg(OH)2↓
B.向足量NaHSO4溶液中逐滴加入Ba(HCO3)2溶液:HCO3-+Ba2++H++SO42-=BaSO4↓+H2O+CO2↑
C.酸性KMnO4溶液与H2O2反应:2MnO4-+10H++3H2O2=2Mn2++3O2↑+8H2O
D.向Fe(NO3)3溶液中加入过量HI溶液:Fe3++3NO3-+12H++10I-=Fe2++3NO↑+5I2+6H2O
难度: 简单查看答案及解析
-
一定温度下,某容器中加入足量碳酸钙,发生反应CaCO3(s)
CaO(s)+CO2(g)达到平衡,下列说法正确的是
A.将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度为原来的2倍
B.CaCO3(s)加热分解生成CaO(s)和CO2,△s<0
C.将体积增大为原来的2倍,再次达到平衡时,气体密度不变
D.保持容器体积不变,充入He,平衡向逆反应方向进行
难度: 简单查看答案及解析
-
已知:①KMnO4+HCl(浓)→KCl+MnCl2+Cl2↑+H2O(未配平)
②检验Mn2+的存在:5S2O82-+2Mn2++8H2O=10SO42-+2MnO4-+16H+
下列说法中错误的是
A.S2O82-离子中存在一个过氧键(—O—O—),则S2O82-离子中硫元素的化合价为+6
B.反应②若有0.1mol还原剂被氧化,则转移电子0.5mol
C.K2S2O8与浓盐酸混合可得到黄绿色气体
D.反应①配平后还原剂与还原产物之比为8:1
难度: 简单查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次增加,其中一种为金属元素。Y元素在大气中存在两种常见单质,Z与X处于同一主族,q、r、s是由这些元素组成的二元化合物,m、n、p分别是元素Z、X、W的单质,p通常为黄绿色气体。上述物质的转化关系如图所示。下列说法正确的是
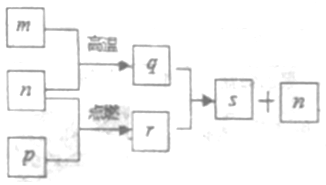
A. 化合物Z2Y2与X2Y2中化学键完全相同
B. 最简单氢化物的沸点:Y>W
C. 36g物质q与过量的物质r反应则有2mol电子发生转移
D. 由Y、Z、W三种元素组成的化合物的水溶液一定显中性
难度: 简单查看答案及解析
-
常温下,向20ml0.01mol·L-1CH3COOH溶液中逐滴加入0.01 mol·L-1的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如图所示,下列说法不正确的是
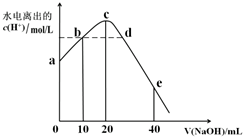
A.从a到c,醋酸的电离始终受到促进
B.从b→c的过程中,既存在着pH=7的点,也存在着溶液中水所电离出的c(H+)=10-7的点
C.b点:2c(Na+)=c(CH3COO-)+c(CH3COOH)
D.a、d对应的纵坐标数值分别是:>10-12、>10-7
难度: 中等查看答案及解析
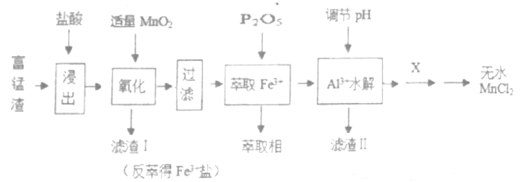
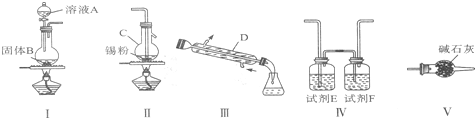
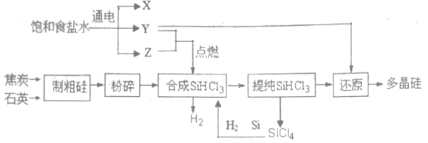
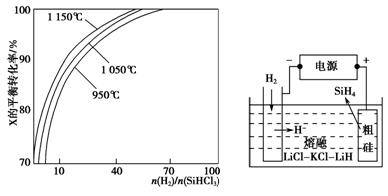
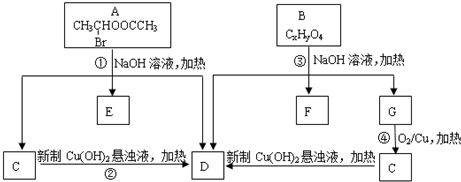
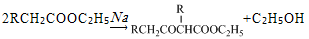 。
。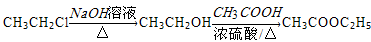 。
。