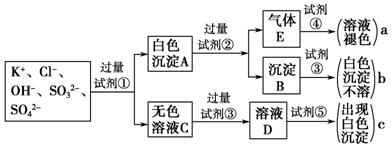
-
根据中学化学教材所附元素周期表判断,下列叙述不正确的是
A.若周期表中第七周期完全排满共有32种元素
B.周期表中共有18个列,其中形成化合物种类最多的在第14列
C.除过渡元素外周期表中最外层电子数相同的元素都位于同一族中
D.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
难度: 中等查看答案及解析
-
下列叙述中,正确的是
A. 化学反应中物质变化的实质是旧化学键的断裂和新化学键的形成
B. 离子化合物中一定有金属元素
C. 蛋白质溶液、淀粉溶液和葡萄糖溶液都是胶体
D. 共价化合物中各原子都一定满足最外层8电子稳定结构
难度: 中等查看答案及解析
-
2009年6月5日是第三十八个世界环境日,该年度世界环境日的主题是:冰川消融,后果堪忧。在近百年间,全球平均气温升高了0.74℃,预计到本世纪末全球气温将升高1.1~6.4℃。下列做法可以减缓全球气温升高的是
①大力进行植树造林;②以煤等燃料为主要生活燃料;③鼓励私人购买和使用小汽车以代替公交车;④利用太阳能、风能和氢能新能源代替化石燃料;⑤禁止电动自行车上路
A.①③④ B.②⑤ C.①④ D.②③⑤
难度: 中等查看答案及解析
-
2010年4月7日,俄罗斯科学家宣布在实验中获得了
和
两种新原子。下列有关这两种原子的说法错误的是
A.质量数均超过质子数的两倍 B.互称为同位素
C.中子数分别为176、177 D.是同一种核素
难度: 中等查看答案及解析
-
已知R2+有b个中子,核外有a个电子,表示R原子符号正确的是
难度: 中等查看答案及解析
-
下列变化过程中,只破坏共价键的是
A.I2升华 B.NaF加热熔融
C.HCl溶于水得盐酸 D.蔗糖溶解
难度: 中等查看答案及解析
-
下列物质的电子式书写正确的是
A.NaCl:
B.H2S:
C.硫离子结构示意图:
D.NH4I:
难度: 中等查看答案及解析
-
门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关 X性质的描述中错误的是
A.X单质不易与水反应 B.XO2可被碳或氢气还原为X
C.XCl4的沸点比SiCl4的高 D.XH4的稳定性比SiH4的高
难度: 中等查看答案及解析
-
低合金高强度钢Q460是支撑“鸟巢”的铁骨钢筋,除含有铁元素外,还含有Mn(锰)、Ti(钛)、Cr(铬)、Nb(铌)等合金元素,下列有关说法正确的是
A.Fe位于元素周期表的第四周期、第ⅧB族
B. Q460比纯铁的硬度大
C.
TiO2、
TiO2、
TiO2互为同位素
D.
Nb3+原子核内有51个中子,核外有41个电子
难度: 中等查看答案及解析
-
下列说法不正确的是
① H2O2分子中既含极性键又含非极性键
② 若R2—和M+的电子层结构相同,则原子序数:R>M
③ F2、Cl2、Br2、I2熔点随相对分子质量增大而升高
④ NCl3、PCl3、CO2、CS2分子中各原子均达到8e-稳定结构
⑤ 若X的质子数为a,中子数为b,则原子可表示为abX
⑥ 由于非金属性Cl>Br>I,所以酸性HCl>HBr>HI
⑦ 由于氨和水分子之间能形成氢键,NH3分子极易溶于水
⑧ 原子序数为34号的元素属于长周期的副族元素
A.②⑤⑥⑧ B.①③④⑤ C.②④⑤⑦ D.③⑤⑦⑧
难度: 中等查看答案及解析
-
A、B、C为三种短周期元素,A、B在同周期, A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构。下列说法中,正确的是
A. 原子序数:A>B>C B. 原子半径:A>B>C
C. 离子半径:A2->B2+>C- D. 原子最外层电子数:A>C>B
难度: 中等查看答案及解析
-
下列各组粒子,核外电子总数和质子总数均相同的是
A.S2-和HS- B.H3O+ 和OH- C.Na+ 和NH4+ D. K+ 和Ne
难度: 中等查看答案及解析
-
把下列物质分别加入装有水的锥形瓶里立即塞紧U形管的塞子,已知U形管内预先装有少量水(为使水容易观察,预先染成红色)。如图所示,结果U型管右边液面升高,则加入的物质可能是①NaOH固体 ②浓H2SO4 ③NH4NO3晶体 ④Na2O2 ⑤生石灰
A.①②④⑤ B.①②③ C.②③⑤ D.③④⑤
难度: 中等查看答案及解析
-
在指定条件下能够大量共存的一组离子是
A.在pH=13的溶液中:Na+、Ba2+、Cl-、NO3-
B.使石蕊试液变红的溶液:Na+、ClO-、Cl-、NO3-
C.无色溶液: Cu2+、K+、SO42-、Cl-
D.强碱性溶液:K+、Mg2+、NO3-、HCO3-
难度: 中等查看答案及解析
-
下列属于放热反应的是
A. C+CO2 B.Ba(OH)2·8H2O+NH4Cl(固体)
C. KClO3受热分解 D. CaO+H2O
难度: 中等查看答案及解析
-
下列离子方程式的书写正确的是
A.实验室用大理石和稀盐酸制取CO2:2H++CO32— = CO2↑+H2O
B.实验室用二氧化锰和浓盐酸制取Cl 2:MnO2+4HCl (浓)=Mn2++ Cl 2↑+2H2O+ 2C1-
C.C12与NaOH溶液反应:Cl2+OH-=C1-+C1O-+H2O
D.实验室用硅酸钠溶液和稀盐酸制取硅酸胶体:2H++SiO32-=H2SiO3 (胶体)
难度: 中等查看答案及解析
-
“绿色化学实验”已走进课堂,下列做法符 合“绿色化学”的是 ①实验室收集氨气采 用图1所示装置 ②实验室中做氯气与钠的反应实验时采用图2所示装置 ③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验 ④实验室中采用图3所示装置进行铜与稀硝酸的反应
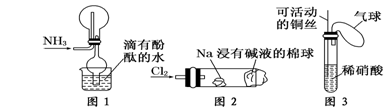
A.②③④ B.①②③ C.①②④ D.①③④
难度: 中等查看答案及解析
-
已知常温下氯酸钾与浓盐酸反应能放出氯气,现按右下图进行卤素的性质实验。玻璃管内分别装有滴有少量不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是
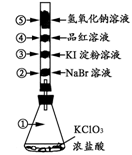
①
②
③
④
A
黄绿色
橙色
蓝色
红色
B
黄绿色
橙色
蓝色
白色
C
黄绿色
无色
紫色
红色
D
无色
橙色
紫色
白色
难度: 中等查看答案及解析
-
NaHSO4在熔融态或者溶于水时都存在的离子是:
A. Na+ B.H+ C. HSO4- D. SO42-
难度: 中等查看答案及解析
-
下列说法正确的是
A.SiH4比CH4稳定
B.O2-半径比F-的小
C.Na与Cs属于第ⅠA族元素,Cs失电子能力比Na的强
D.P和As属于第ⅤA族元素,H3PO4酸性比H3AsO4的弱
难度: 中等查看答案及解析
-
分析如下残缺的反应:RO3-+________+6H+=3R2+3H2O。下列叙述正确的是
A.元素R位于周期表中第ⅤA族
B.RO中的R只能被还原
C.R2在常温常压下一定是气体
D.若1 mol RO参与该反应,则转移的电子的物质的量为5 mol
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列说法正确的是
A.1moINH2—含有10NA个电子
B.32gCH4中含有2NA个C—H键
C.5.3Na2CO3溶于100mL水,溶液中Na +的浓度为0.1mol/L
D.1moINa2O2与足量H2O反应,转移电子数为2NA
难度: 中等查看答案及解析
-
下列事实与氢键有关的是
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、GeH4、SnH4熔点逐渐升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
难度: 中等查看答案及解析
-
下列说法正确的是
A.原子最外层电子数等于或大于3(小于8)的元素一定是主族元素
B.原子最外层只有1个电子的元素一定是金属元素
C.最外层电子数比次外层电子数多的主族元素一定位于第二周期
D.元素的主族序数m与周期数n之比m:n=1,该元素一定是金属元素
难度: 中等查看答案及解析
-
下图是元素周期表中短周期的一部分,X、Y、Z、W四种元素的原子核外最外层电子数之和等于Y、Z元素的原子序数之和。下列说法不正确的是( )
A.X元素形成的气态氢化物分子的空间结构是三角锥形
B.Z与Y元素形成的化合物熔点很高
C.已知W单质分子间作用力较大,则其加压时易液化
D.Z的最高价氧化物能溶于X的最高价氧化物的水化物中
难度: 中等查看答案及解析
-
下列指定微粒的个数比为2:1的是
A. Be2+离子中的质子和电子 B. 21H原子中的中子和质子
C. NaHCO3晶体中的阳离子和阴离子 D. BaO2(过氧化钡)固体中的阴离子和阳离子
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合价见下表:
元素符号
X
Y
Z
R
T
原子半径(nm)
0.160
0.111
0.104
0.143
0.066
主要化合价
+2
+2
-2,+4,+6
+3
-2
根据表中信息,判断以下说法正确的是
A.单质与稀硫酸反应的速率快慢:R>Y>X
B.离子半径:T2->X2+
C.元素最高价氧化物对应的水化物的碱性:Y > R >X
D.形成氢化物的沸点:T>Z
难度: 中等查看答案及解析
-
稀土是工业味精,邓小平说过“中东有石油,我们有稀土”。稀土元素铈(Ce)主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是
A.已知Ce原子序数是58,则其为镧系元素
B.铈有四种稳定的核素
Ce、
8Ce、
Ce、
Ce,它们互为同位素
C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+
D.铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑
难度: 中等查看答案及解析
-
化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能(kJ/mol):P—P:198,P—O:360,O===O:498,则反应P4(白磷)+3O2===P4O6,0.5mol P4的完全反应时吸放热为
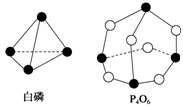
A.放热1 638 kJ B.吸热1 638 kJ
C.放热819 kJ D.吸热126 kJ
难度: 中等查看答案及解析
-
将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL OH-浓度为1mol/L的溶液,以及一定量的H2;然后用1 mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是
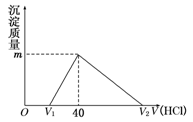
A.图中m值为1.56 g
B.标准状况下产生氢气896 mL
C.原合金质量为0.92 g
D.图中V2为60 mL
难度: 中等查看答案及解析