-
2010年上海世博会的主题是“城市,让生活更美好“.大会提倡低碳、节能、环保,下列措施中不符合该主题的是( )
A.世博园区公共交通使用的是纯电动汽车
B.日本馆的外壳使用非晶硅薄膜,以充分利用太阳能
C.游客为了方便大量使用一次性塑料袋
D.世博停车场安装催化光解设施,可将汽车尾气中CO和NOX反应生成无毒气体难度: 中等查看答案及解析
-
科学家P.Tatapudi等人首先使用在空气中电解水(酸性条件下)的方法在阳极制得臭氧,阴极制得过氧化氢.电解总方程式为:3H2O+3O2═3H2O2+O3,下列说法正确的是( )
A.电解产物在应用中都只能作为氧化剂
B.电解一段时间后,溶液pH不变
C.每生成1molO3转移电子数为3mol
D.阳极的反应:3H2O→O3+6H++6e-难度: 中等查看答案及解析
-
下列叙述不正确的是( )
A.原电池是将化学能转化为电能的装置
B.铁船底镶嵌锌块,锌作负极,以防船体被腐蚀
C.钢铁腐蚀的正极反应:Fe-3e-=Fe3+
D.工业上电解饱和食盐水的阳极反应:2Cl--2e-=Cl2↑难度: 中等查看答案及解析
-
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
物质
编号物质转化关系 甲 乙 丙 丁 ① 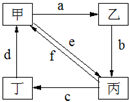
Cu CuO CuCl2 Cu(NO3)2 ② Na2CO3 NaOH NaHCO3 CO2 ③ (NH4)2SO3 CaSO3 SO2 NH4HSO3 ④ Al(OH)3 Al2O3 Na[Al(OH)4] AlCl3
A.①②③④
B.①②③
C.①③④
D.②④难度: 中等查看答案及解析
-
关于下列图示的说法中正确的是( )
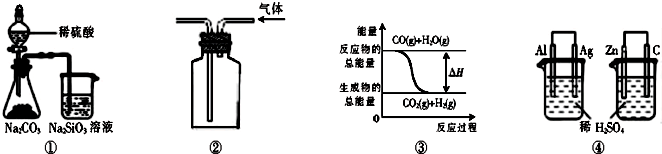
A.用图①所示实验可比较硫、碳、硅三种元素的非金属性强弱
B.用图②所示实验装置排空气法收集CO2气体
C.图③表示可逆反应CO(g)+H2O(g)CO2(g)+H2(g)的△H大于0
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同难度: 中等查看答案及解析
-
常温下,用 0.1000mol/LNaOH溶液滴定 20.00mL0.1000mol/LCH3COOH溶液所得滴定曲线如下图.下列说法正确的是( )

A.滴定过程中可能出现:C(CH3COOH)>C(CH3COO-)>C(H+)>C(Na+)>C(OH-)
B.点①所示溶液中:C(CH3COO-)+C(OH-)=C(CH3COOH)+C(H+)
C.点②所示溶液中:C(Na+)=C(CH3COOH)+C(CH3COO-)
D.点③所示溶液中:C(Na+)>C(OH-)>C(CH3COO-)>C(H+)难度: 中等查看答案及解析
-
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应是:A(g)+xB(g)⇌2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示.下列说法中正确是( )
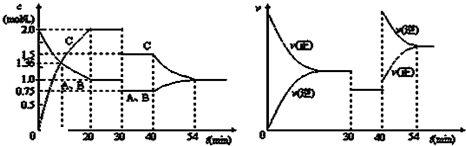
A.在一定条件下,当 v(正)A:v(逆)C=1:2时的状态即为化学平衡状态
B.20min时A的反应速率为0.5mol/
C.反应方程式中的x=1,正反应为吸热反应
D.30min时降低温度,40min时升高温度难度: 中等查看答案及解析
-
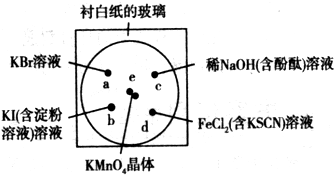
某兴趣小组设计如下装置进行氯气与金属钠的反应,先将钠预热,在钠熔融成小球时,撤火,并通入氯气即发生反应,下列叙述中错误的是( )
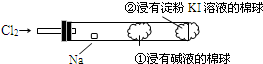
A.钠着火剧烈燃烧产生淡黄色的火焰
B.反应产生的大量白烟是氯化钠固体
C.棉球①的作用是吸收过量氯气防止产生污染
D.棉球②变蓝色则证明氯气已被碱液完全吸收难度: 中等查看答案及解析
-
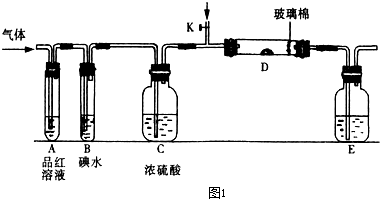
如图所示,X为铁、Y是石墨电极,a是饱和食盐水,实验开始前,在U形⇌管的两边同时各滴入几滴酚酞试液,下列叙述错误的是( )
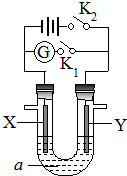
A.合上K1、断开K2,该装置可以将化学能转变为电能
B.合上K1、断开K2,X是阴极,Y电极附近溶液慢慢变为红色
C.合上K2、断开K1,湿润的KI淀粉试纸靠近Y电极管口,试纸变蓝
D.合上K2、断开K1,电解一段时间,X电极附近溶液呈红色难度: 中等查看答案及解析
-
一定条件下用甲烷可以消除氮氧化物(NOx)的污染.已知:
①CH4 ( g )+4NO2( g )=4NO( g )+CO2( g )+2H2O( g )△H=一574kJ•mol-1
②CH4 ( g )+4NO( g )=2N2( g )+CO2( g )+2H2O( g )△H=一1 160kJ•mol一1.
下列正确的选项是( )
A.CH4 ( g )+2NO2 ( g )=N2( g )+CO2 ( g )+2H2O ( l)△H=一867 kJ•mol-1
B.CH4催化还原NOx为N2的过程中,若x=1.6,则转移的电子总数为3.2 mol
C.若0.2 mol CH4还原NO2至N2,在上述条件下放出的热量为173.4 kJ
D.若用标准状况下4.48L CH4 还原NO2至N2,整个过程中转移的电子总数为3.2 mol难度: 中等查看答案及解析
-
下列有关事实或现象的解释正确的是( )
A.SO2气体能使品红和酸性高锰酸钾溶液褪色,且原理相同
B.氨气可将NO2转化成无毒的物质,是因为氨气具有还原性
C.NH4NO3溶液和HNO3溶液中滴加石蕊都变红色,是因为它们均能电离出H+
D.pH=3的盐酸与pH=11的MOH溶液等体积混合后溶液呈酸性,说明MOH为弱碱难度: 中等查看答案及解析
-
将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol•L-1稀盐酸.下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A.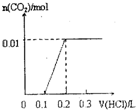
B.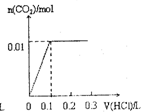
C.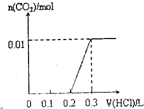
D.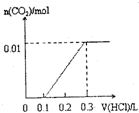
难度: 中等查看答案及解析
-
广口瓶被称为气体实验的“万能瓶”,是因为它可以配合玻璃管和其它简单仪器组成各种功能的装置.下列各图中能用作防倒吸安全瓶的是( )
A.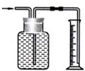
B.
C.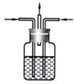
D.
难度: 中等查看答案及解析
-
下列反应的离子方程式的书写中,正确的是( )
A.用惰性电极电解MgCl2溶液:2Cl-+2H2O2OH-+Cl2↑+H2↑
B.向氢氧化钠溶液中通入少量二氧化硫:SO2+OH-=HSO3-
C.碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
D.将磁性氧化铁溶于盐酸:难度: 中等查看答案及解析
-
下列说法正确的是( )
A.0.1mol Na2O2与足量CO2反应转移的电子的物质的量为0.2mol
B.非金属氧化物不一定是酸性氧化物,但金属氧化物都为碱性氧化物
C.电解熔融氯化钠制取金属钠的反应中,钠离子被还原,氯离子被氧化
D.某酸雨样本采集后放置一段时间,pH由4.68变为4.28,是因为水中溶了较多的CO2难度: 中等查看答案及解析