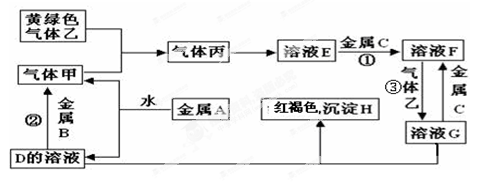
-
“脚印”、“笑脸”、“五环”等焰火让北京奥运会开幕式更加辉煌壮观,这些焰火与元素的焰色反应有关。下列说法错误的是
A.观察K2SO4的焰色应透过蓝色的钴玻璃
B.Na与NaCl在灼烧时火焰颜色相同
C.可以用焰色反应来区别NaCl和KCl
D.焰色反应一定发生化学变化
难度: 简单查看答案及解析
-
化学知识在日常生活中有很多应用,下列说法正确的是
A.用食盐清洗热水瓶中的水垢
B.漂白粉在空气中容易变质的原因是Ca(ClO)2见光分解
C.加碘食盐,能使淀粉显蓝色
D.氯水应避光保存,是因为HClO见光分解
难度: 中等查看答案及解析
-
常温下能用铝制容器盛放的是
A.稀硫酸 B.氢氧化钠溶液 C.浓硫酸 D.硫酸铜溶液
难度: 中等查看答案及解析
-
仅用下表提供的玻璃仪器(非玻璃仪器任选)或实验装置(图1、图2)就能实现相应实验目的是
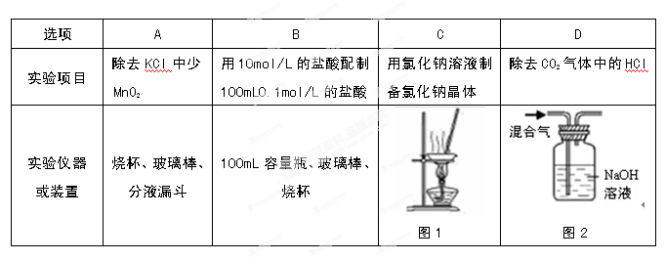
难度: 中等查看答案及解析
-
下列说法错误的是
A.钠在空气中燃烧所得产物为Na2O2
B.镁因在空气中形成了一薄层致密的氧化膜,保护了里面的镁,故镁不需要像钠似的进行特殊保护
C.铝制品在生活中非常普遍,这是因为铝不活泼
D.铁在潮湿的空气中因生成的氧化物很疏松,不能保护内层金属,故铁制品往往需涂保护层
难度: 中等查看答案及解析
-
下列物质中,属于纯净物的是
①陶瓷,②水泥,③玻璃,④漂白粉,⑤胆矾,⑥氯水,⑦液氯
A.③⑦ B.③④⑥ C.⑤⑦ D.⑥⑦
难度: 简单查看答案及解析
-
随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中应放入的化学物质是
A.无水硫酸铜、蔗糖 B.硅胶、硫酸亚铁
C.食盐、硫酸亚铁 D.生石灰、食盐
难度: 中等查看答案及解析
-
下列物质之间的转化不能通过化合反应一步完成的是
A.SiO2 →H2SiO3 B.Fe →FeCl2
C.Cu → CuCl2 D.Fe(OH)2 → Fe(OH)3
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A. 向氯化铝溶液中加入足量氨水:Al3+ + 4NH3·H2O == AlO2- + 2H2O +4NH4+
B. AlCl3溶液中加入足量的氨水:Al3++3OH-===Al(OH)3↓
C. 三氯化铁溶液中加入铁粉:Fe3++Fe===2Fe2+
D. FeCl2溶液跟Cl2反应:2Fe2++Cl2===2Fe3++2Cl-
难度: 中等查看答案及解析
-
下列离子在酸性溶液中能大量共存的是
A.
B.
C.Al3+、Fe2+、NO3-、Cl- D.K+、Na+、Cl-、SiO32-
难度: 中等查看答案及解析
-
下列反应中,水作还原剂的是
A.2Na+2H2O=2NaOH+H2↑ B.Cl2+H2O=HCl+HClO
C.2F2+2H2O=4HF+O2 D.SO2+H2O=H2SO3
难度: 中等查看答案及解析
-
材料与化学密切相关。下列物质与材料对应关系不正确的是
A.晶体硅——光导纤维 B.氧化铝——耐火材料
C.铁碳合金——碳素钢 D.硅酸盐——普通玻璃
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数,下列说法正确的是
A.1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA
B.标准状况下,22.4 L NH3中含有电子数为8NA
C.1 mol Cl2与足量Fe反应转移电子数为3NA
D.1 mol·L-1的AlCl3溶液中, Cl-的数目为3NA
难度: 中等查看答案及解析
-
下列叙述中正确的是
A.Al、Fe、Cu三者对应的氧化物均为碱性氧化物
B.Fe3+有氧化性,所以可以用FeCl3溶液来回收旧电路板中的铜
C.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O===2Al(OH)3↓+CO32-
D.加入铝粉能产生H2的溶液中,一定存在大量的Na+、Ba2+、AlO2-、Cl-
难度: 中等查看答案及解析
-
下列有关硅元素的叙述中,正确的是
A.水玻璃可用作木材防火剂 B.SiO2是良好的半导体材料
C.硅是地壳中含量最多的元素 D.SiO2不溶于水,也不溶于任何酸
难度: 简单查看答案及解析
-
关于Na2CO3和NaHCO3性质的有关叙述正确的是
A.在水中的溶解性:Na2CO3<NaHCO3
B.热稳定性:Na2CO3<NaHCO3
C.与酸反应的快慢:Na2CO3<NaHCO3
D.Na2CO3不能转化成NaHCO3,而NaHCO3能转化为Na2CO3
难度: 中等查看答案及解析
-
常温下,在水溶液中发生如下反应
①16H++10C-+2XO4 - = 2X2++5C2+8H2O;②2A2++B2 = 2A3++2B-;③2B-+C2 = B2+2C-。下列说法错误的
A.反应C2 + 2A2+ = 2A3+ + 2C- 可以进行
B.还原性由强到弱的顺序是C->A2+>B->X2+
C.氧化性由强到弱的顺序是XO4- >C2>B2>A3+
D.反应③是置换反应
难度: 中等查看答案及解析
-
一定条件下,使CO和O2的混合气体26 g充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增加14 g,则原混合气体中CO和O2的物质的量之比是
A.4:9 B.1:1 C.7:6 D.4:3
难度: 中等查看答案及解析
-
某溶液中大量存在以下五种离子:NO3-、SO42-、Fe3+、H+、M,其物质的量之比为n(NO3-)∶n(SO42-)∶n(Fe3+)∶n(H+)∶n(M)=2∶3∶1∶3∶1, 则 M可能为
A.Fe2+ B.Mg2+ C.CO32- D.Ba2+
难度: 中等查看答案及解析
-
下列说法正确的是
A.加入氯化钡溶液有白色沉淀生成,再加稀盐酸,沉淀不消失,一定有硫酸根离子
B.Na2O2与CO2反应,Na2O2是氧化剂、CO2是还原剂
C.向新制的FeSO4溶液中滴入适量的NaOH溶液,放置片刻,整个反应过程的颜色变化是:浅绿色溶液 →白色沉淀→灰绿色沉淀→红褐色沉淀
D.称取等质量的两份铝粉,分别加入过量的稀盐酸和过量的NaOH溶液,则放出氢气的体积(同温同压下)不相等
难度: 困难查看答案及解析
-
下列离子方程式书写正确的是
A.Fe(OH)3溶于足量氢碘酸:Fe(OH)3+ 3H+=Fe3++ 3H2O
B.用醋酸除去水垢:CaCO3+2H+=Ca2++ H2O+CO2↑
C.氯气与水的反应:Cl2+H2O=2H++Cl—+ClO—
D.将NaOH溶液滴入Ca(HCO3)2溶液中:Ca2++HCO3—+OH—=CaCO3↓+H2O
难度: 中等查看答案及解析
-
FeCl3和CuCl2混合液中,加入一定量的铁粉,充分反应后,溶液中的金属离子不可能是
A.仅有Fe2+ B.有Cu2+ 、Fe2+ 和Fe3+
C.仅有Cu2+ 和Fe2+ D.仅有 Fe3+ 和Fe2+
难度: 中等查看答案及解析
-
氯气与冷的氢氧化钠反应生成NaCl与NaClO,与热的氢氧化钠反应生成NaCl与NaClO3.一定温度下,氯气与氢氧化钠反应生成的NaClO与NaClO3的物质的量之比为2:3,求该反应氧化产物与还原产物的物质的量之比为
A、5/16 B、5/17 C、5/13 D、13/5
难度: 中等查看答案及解析
-
将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。右边图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是

难度: 困难查看答案及解析
-
有Al、CuO、Fe2O3组成的混合物共10.0 g,放入500 mL某浓度的盐酸溶液中,混合物完全溶解,当再加入250 mL 2.0 mol/L的NaOH溶液时,得到的沉淀最多。上述盐酸溶液的浓度为
A.0.5 mol/L B.1.0 mol/L C.2.0 mol/L D.3.0 mol/L
难度: 中等查看答案及解析