-
下列关于化学与生产、生活的认识不正确的是
A.使用清洁能源是防止酸雨发生的重要措施之一
B.CO2是造成酸雨发生的罪魁祸首
C.NO2是造成光化学烟雾的气体
D.合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧张
难度: 简单查看答案及解析
-
下列有关NO2与H2O反应的说法中,正确的是
A.NO2只作氧化剂 B.NO2只作还原剂
C.NO2既作氧化剂,又作还原剂 D.NO2既不作氧化剂,也不作还原剂
难度: 中等查看答案及解析
-
用如图所示装置进行下列实验,实验结果与预测的现象不一致的是
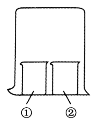
选项
①中的物质
②中的物质
预测的现象
A
淀粉-KI溶液
浓硝酸
①中溶液变蓝
B
浓盐酸
浓氨水
大烧杯上部出现白烟
C
酚酞试液
浓盐酸
①中溶液变红
D
湿润红纸条
饱和氯水
红纸条褪色
难度: 中等查看答案及解析
-
是常规核裂变产物之一。下列有关
的叙述中不正确的是
A.
的化学性质与
相同
B.
的原子序数为53
C.
的原子核外电子数为78
D.
的原子核内中子数多于质子数
难度: 简单查看答案及解析
-
实验室保存下列化学药品的方法不妥当的是
A.将新制氯水保存在棕色试剂瓶中
B.将NaOH溶液保存在带玻璃塞的细口试剂瓶中
C.将少量钾、钠保存在煤油中
D.将浓硝酸溶液保存在棕色试剂瓶中
难度: 中等查看答案及解析
-
下图是实验室进行“喷泉”实验的一种装置,使用下列物质一定不会出现“喷泉”现象的是
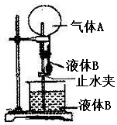
选项
气体A
液体B
A
HCl
水
B
SO2
NaOH溶液
C
Cl2
饱和食盐水
D
NH3
稀盐酸
难度: 中等查看答案及解析
-
某短周期非金属元素,其原子核外最外层电子数是次外层电子数的一半,该元素
A.在自然界中以化合态的形式存在 B.单质常用作半导体材料和光导纤维
C.最高价氧化物不与任何酸反应 D.气态氢化物比甲烷稳定
难度: 中等查看答案及解析
-
1989年,IUPAC(国际纯粹与应用化学联合会)建议用1~18列替代原主族、副族等。下列有关说法错误的是
A.元素周期表中第3列的元素种类数最多。
B.金属性最强的元素位于元素周期表的第1列。
C.非金属性最强的元素位于元素周期表的第17列。
D.能形成化合物的种类数最多的元素位于元素周期表的第16列。
难度: 困难查看答案及解析
-
下列混合物可用加热的方法分离的是
A.碘和氯化铵 B.硫酸钾和氯酸钾
C.氯化铵和硫酸钡 D.碳酸氢钠和碳酸氢铵
难度: 中等查看答案及解析
-
下列说法正确的是
A.在粗硅的制取中发生反应2C+SiO2
2CO↑+Si,所以金属性C>Si
B.由Na2CO3+SiO2
CO2↑+Na2SiO3可知硅酸的酸性大于碳酸
C.用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2
D.由H2S+CuSO4==CuS↓+H2SO4可知,氢硫酸的酸性比硫酸强
难度: 中等查看答案及解析
-
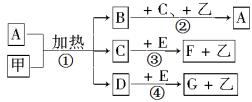
A、B、C、D是含同一元素的四种物质,它们相互之间有如下图的转化关系,图中反应所需的条件均已省略,其中D为某种酸或碱。
则A不可能是下列物质中的
A.S B.NH3 C.Fe D.Na
难度: 中等查看答案及解析
-
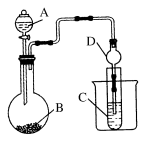
某实验过程如图所示:

下列有关图③中出现的现象及解释合理的是
A.铜片溶解,因铜与稀H2SO4反应生成SO2
B.铜片溶解,产生无色气体,该气体为H2
C.无明显现象,因稀H2SO4不与铜反应
D.铜片溶解,产生无色气体,该气体在试管口变为红棕色
难度: 中等查看答案及解析
-
对于溶液中某些离子的检验及结论一定正确的是
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,一定有CO32-
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
C.加入氢氧化钠溶液,加热,产生使湿润的红色石蕊试纸变蓝的气体,一定有NH4+
D.加入氨水直至氨水过量,先产生白色沉淀,后沉淀消失,一定有Al3+
难度: 困难查看答案及解析
-
已知A2+、B+、C3—、D— 是第三周期元素的四种离子。下列叙述中正确的是
A.四种离子都具有相同的电子层结构
B.原子半径:r(D)> r(C)> r(A)> r(B)
C.离子半径:r(B+)> r(A2+)> r(C3—)> r(D—)
D.B、D两元素的最高价氧化物的水化物在溶液中反应的离子方程式可表示为H++OH—=H2O
难度: 困难查看答案及解析
-
下列有关物质的性质、反应现象的描述及其原理解释均正确,且符合因果关系的是
选项
物质的性质或反应现象
原理解释
A
SO2通入溴水,溴水褪色
SO2有漂白性
B
碱性:NaOH>Al(OH)3
金属性:Na>Al
C
白磷比N2的性质活泼
非金属性:P>N
D
少量Na投入CuSO4溶液中,Na可以置换出Cu
活泼性:Na>Cu
难度: 中等查看答案及解析
-
4.6g铜和镁的合金完全溶于浓硝酸,反应后硝酸被还原只生成4480mL的NO2气体和336mL的N2O4气体(气体体积都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为
A.9.02g B.8.51g C.8.26g D.7.04g
难度: 极难查看答案及解析