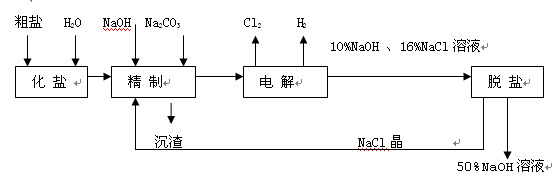
-
下列离子反应方程式书写正确的是
A.钠溶于水的反应:2Na+2H2O=2NaOH+H2↑
B.碳酸钠溶液和稀醋酸反应:CO2-3+2H+=H2O+CO2↑
C.向Ba(OH)2溶液中逐滴加入硫酸氢钠溶液至中性:2H++SO2-4+Ba2++2OH-=BaSO4↓+2H2O
D.硫化亚铁中加入稀硝酸:FeS+2H+=Fe2++H2S↑
难度: 中等查看答案及解析
-
在下面的电子结构中,第一电离能最小的原子可能是
A.ns2np3 B.ns2np5 C.ns2np4 D.ns2np6
难度: 中等查看答案及解析
-
有相同体积、相等pH的烧碱溶液和氨水,下列叙述中正确的是
A.两溶液的物质的量浓度相同
B.用同浓度的盐酸中和时,消耗盐酸的体积相同
C.升高温度10℃,两溶液的pH仍相等
D.两溶液中OH-离子浓度相同
难度: 中等查看答案及解析
-
在密闭容器中,1mol HI分解[2HI(g)
H2(g)+I2(g)]时,I2的体积分数为X%;相同条件下,2 mol HI分解达平衡时,I2的体积分数为Y%,则X与Y的关系为
A. X<Y B. X=Y C. X>Y D. X=Y/2
难度: 中等查看答案及解析
-
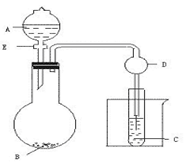
下列气体的制备可采用右图装置的是

A.铜与浓硝酸反应制NO2
B.铜与稀硝酸反应制NO
C.乙醇与浓硫酸反应制乙烯
D.石灰石和盐酸
难度: 中等查看答案及解析
-
非整比化合物Fe0..95O具有NaCl型晶体结构。由于n (Fe)∶n (O)<1,所以晶体存在缺陷。Fe0..95O可表示为
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下列关于晶体说法的正确组合是
①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
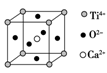
⑤CaTiO3晶体中(晶胞结构如上图所示)每个Ti4+和12个O2-紧邻
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
A.①②③⑥ B.①②④
C.③⑤⑦ D.③⑤⑧
难度: 中等查看答案及解析