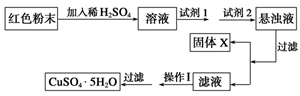
-
化学知识在生产和生活中有着重要的应用。下列说法中正确的是
①钠的还原性很强,可以用来冶炼金属钛、钽、铌、锆等
②K、Na合金可作原子反应堆的导热剂
③发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔
④Na2O2既可作呼吸面具中O2的来源,又可漂白织物、麦杆、羽毛等
⑤碳酸钠在医疗上是治疗胃酸过多的一种药剂 ⑥明矾常作为消毒剂
A.①②③④ B.①②③④⑤ C.①②③④⑥ D.①②③④⑤⑥
难度: 中等查看答案及解析
-
设NA 表示阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,0.1 mol Cl2 溶于足量水,转移的电子数目为0.1NA
B.0.1 mol Fe 与足量的稀HNO3 反应,转移0.2N A 个电子
C.1 L 0.1 mol·L-1 Na2CO3液含有0.1NA 个CO3 2-
D.电解NaCl熔融液得到7.1g Cl2,理论上需要转移0.2NA个电子
难度: 中等查看答案及解析
-
常温下,下列溶液中一定能大量共存的离子组是
A.含有大量Fe2+的溶液:ClO-、Na+、Cl-、SO42-
B.能使氢氧化铝迅速溶解的溶液:Na+、Fe2+、NO3-、SO42-
C.pH=0的溶液:NH4+、Na+、SO42-、Fe3+
D.水电离产生的c(H+)=1×10-12mol/L的溶液:HCO3-、NH4+、Cl-、Ca2+
难度: 中等查看答案及解析
-
同温同压下,甲容器中的NH3和乙容器中的CH4所含的原子总数相同,则甲容器与乙容器的体积之比为
A.1:1 B.2:1 C.3:4 D.5:4
难度: 中等查看答案及解析
-
某MgCl2溶液的密度为1.18g/cm3,其中Mg2+离子的质量分数为5.1%,300mL该溶液中Cl-离子的物质的量约等于
A.0.37mol B.0.63mol C.0.74mol D.1.5mol
难度: 中等查看答案及解析
-
某物质溶于水,所得溶液既能使蓝色石蕊试纸变红,也能与碳酸盐反应生成气体,此物质有可能是:①单质 ②氧化物 ③酸 ④碱 ⑤盐
A.①②④ B.①②③⑤ C.② D.①②③④⑤
难度: 中等查看答案及解析
-
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:
a HClO3 = bO2↑+ c Cl2↑+ d HClO4 + e H2O。下列有关说法不正确的是
A.由反应可确定:氧化性HClO3>O2 B.由非金属性Cl>S,可推知酸性HClO3>H2SO4
C.若氯酸分解所得混合气体,lmol混合气体质量为45g,则反应方程式可表示为:
3HClO3 = 2O2↑+ C12↑+ HClO4 + H2O
D.若化学计量数a=8,b=3,则该反应转移电子数为20e-
难度: 中等查看答案及解析
-
对海水进行开发利用的部分流程如下图所示。下列说法不正确的是
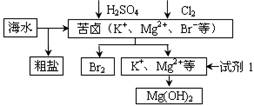
A.可用BaCl2溶液除去粗盐中的SO42-
B.从苦卤中提取Br2的反应的离子方程式为:2Br- + Cl2 == 2Cl- + Br2
C.试剂1可以选用石灰乳
D.工业上,电解熔融Mg(OH)2冶炼金属镁
难度: 中等查看答案及解析
-
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X。它们有如下的转化关系(部分产物及反应条件已略去):
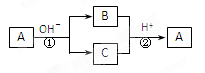
下列判断正确的是:
A.X元素可能为Al
B.X元素一定为非金属元素
C.反应①和②互为可逆反应
D.反应①和②不一定为氧化还原反应
难度: 中等查看答案及解析
-
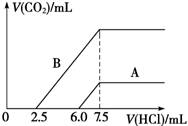
现有25mL 2mol·L-1的Na2CO3溶液和75mL 1mol·L-1的稀盐酸。
(1)将Na2CO3溶液逐滴滴入稀盐酸中; (2)将稀盐酸逐滴滴入Na2CO3溶液中。
两操作的现象及结果(标准状况下)为:
A.现象相同,所得气体的体积相等 B.现象相同,所得气体的体积不等
C.现象不同,所得气体的体积相等 D.现象不同,所得气体的体积不等
难度: 中等查看答案及解析
-
将溶液(或气体)X逐渐加入(或通入)到一定量Y溶液中,产生沉淀的质量与加入X的物质的量关系如右图所示,符合图中这一情况的一组物质是
X
Y
A
Ba(HCO3)2溶液
NaOH溶液
B
CO2气体
石灰水
C
KOH溶液
Mg(HSO4)2溶液
D
Na2CO3溶液
CaCl2溶液
难度: 中等查看答案及解析
-
在四个烧杯内分别加入200mlH2O(足量),然后各加入:①钠、②氧化钠、③过氧化钠、④氢氧化钠固体,搅拌使之完全溶解,则四个烧杯内所得溶液的质量分数的大小顺序正确的是
A.若固体的质量相等,则:②=③>①>④
B.若固体的物质的量相等,则:②=③>①>④
C.若固体的质量相等,则:③>②>④>①
D.若固体的物质的量相等,则:①>②>③>④
难度: 中等查看答案及解析
-
双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO3。关于该物质的说法正确的是( )
A.该物质属于两性氢氧化物 B.该物质是Al(OH)3和Na2CO3的混合物
C.1 mol NaAl(OH)2CO3最多可消耗3 mol H+ D.该药剂不适合于胃溃疡患者服用
难度: 中等查看答案及解析
-
将1.12 g铁粉加入25 mL 2 mol/L的氯化铁溶液中,充分反应后,其结果是( )
A.铁粉有剩余,溶液呈浅绿色,Cl-基本保持不变
B.往溶液中滴入无色KSCN溶液,溶液变红色
C.Fe2+和Fe3+物质的量之比为5∶1
D.氧化产物和还原产物的物质的量之比为2∶5
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
①氯气与水反应:Cl2+H2O===2H++Cl-+ClO-
②氯气与氢氧化钠溶液反应:Cl2+2OH-===Cl-+ClO-+H2O
③浓盐酸与二氧化锰共热:MnO2+4HClMn2++2Cl-+Cl2↑+2H2O
④漂白粉溶液中通入少量的二氧化碳气体:Ca2++2ClO-+H2O+CO2===CaCO3↓+2HClO
A.①③ B.②④ C.②③ D.①④
难度: 中等查看答案及解析
-
某化学小组用下图所示装置制取氯气,下列说法不正确的是
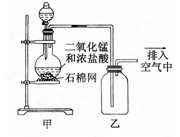
A.该装置图中至少存在两处明显错误
B.将烧瓶中的MnO2换成KMnO4可制得Cl2
C.在乙后连一盛有饱和食盐水的烧杯进行尾气处理
D.在集气瓶的导管口处放一片湿润的淀粉碘化钾试纸可以证明是否有氯气逸出
难度: 中等查看答案及解析