-
每个公民都应该有安全意识,去年频繁发生的有关化学品泄露事件或者爆炸事件一次又一次给我们敲响警钟。下列做法存在安全隐患的是( )
①将水沿着烧杯内壁缓缓加入浓硫酸中,用玻璃棒不断搅拌;②给试管的液体加热时,应将试管倾斜45o角,再集中在药品处加热;③取用金属Na或K时,用剩的药品要放回原瓶;④夜间厨房发生煤气泄露时,应立即开灯检查煤气泄露的原因,并打开所有的门窗通风;⑤在做苯酚的性质实验时,因为常温时苯酚在水中的溶解度较小,所以可以将废液直接通过水池排入水道;⑥废电池应立即回收处理。
A.全部 B.①②④⑤ C.①③⑤ D.①④
难度: 中等查看答案及解析
-
有关于化学实验的操作或者说法中,正确的是( )
A.用加热法测定胆矾晶体中结晶水含量时,若在空气中冷却会使结果偏低
B.配制氯化铁溶液时,先将氯化铁溶于较浓盐酸,再用蒸馏水稀释并加入少量铁粉
C.将甲烷和乙烯的混合气体通过盛有浓溴水的洗气瓶,即可提纯甲烷
D.将蔗糖和稀硫酸混合加热后,再加入银氨溶液并水浴加热,以检验还原性糖
难度: 中等查看答案及解析
-
在下列实验中,不能达到目的的是( )
A、用金属钠分别与水和乙醇反应,确定水和乙醇分子中羟基氢(-OH)的活泼性强弱
B、用石墨作电极,电解Mg(NO3)2 、Cu(NO3)2 的混合溶液,确定铜和镁的金属活动性强弱
C、进行H2O和H2S 的热分解实验,确定硫和氧两种元素的非金属性强弱
D、根据Na2CO3 和Na2SO3 水溶液酸碱性强弱,确定碳和硫两元素非金属性的强弱
难度: 中等查看答案及解析
-
下列叙述中,不正确的是( )
A.原电池负极上发生的反应是氧化反应
B.失电子能力弱的物质获得电子的能力一定强
C.阳离子在氧化还原反应中,可能表现氧化性,也可能表现还原性
D.氯气分子在反应中,作氧化剂的同时也可能是还原剂
难度: 中等查看答案及解析
-
在化学分析中,草酸(H2C2O4)是重要的还原剂,已知20.0mL 0.100 mol·L-1 VO2+离子恰好将20.0 mL 0.050 mol·L-1 H2C2O4完全氧化成CO2,VO2+被还原为VOn+离子,则VOn+中的n值为( )
A. 1 B. 2 C. 3 D. 4
难度: 中等查看答案及解析
-
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:Cl-<Fe2+<H2O2<I-<SO2,则下列反应不能发生的是( )
A.2Fe3++SO2+2H2O = 2Fe2++SO
+4H+ B.I2+SO2+2H2O = H2SO4+2HI
C.H2O2+H2SO4 = SO2↑+O2↑+2H2O D.2Fe2++Cl2 = 2Fe3++2Cl-
难度: 中等查看答案及解析
-
2008年北京奥运会“祥云”火炬用的是环保型燃料——丙烷(C3H8),悉尼奥运会火炬所用燃料为65%丁烷(C4H10)和35%丙烷,已知丙烷的燃烧热为:
-1,下列有关说法正确的是( )
A.奥运火炬燃烧主要是将化学能转变为热能和光能
B.丙烷的沸点比正丁烷高
C.丙烷、空气及铂片可组成燃料电池,在丙烷附近的铂极为电池的正极
D.丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)=3CO2(g)+4H2O(g);△H=-2221.5kJ/mol
难度: 中等查看答案及解析
-
下列说法或表示方法正确的是( )
A. 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B. 由C(石墨)= C(金刚石);△H = +1.90 kJ·mol-1可知,金刚石比石墨稳定
C. 在稀溶液中,H+(aq)+ OH-(aq)= H2O(l);△H = -57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ
D. 在101 kPa时,2 g H2 完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+ O2(g)= 2H2O(l);△H = -285.8 kJ·mol-1
难度: 中等查看答案及解析
-
下列各组离子能在指定溶液中,大量共存的是:( )
①无色溶液中:K+,Cl—,Na+,MnO4—,NO3—,SO42—
②使PH=11的溶液中:CO32—,Na+,AlO2—,NO3—,S2—,SO32—
③水电离的H+浓度C(H+)=10—12mol·L—1的溶液中:Cl—,HCO3—,NO3—,NH4+,S2O32—
④加入Mg能放出H2的溶液中:Mg2+,NH4+,Cl—,K+,SO42—
⑤使甲基橙变红的溶液中:Fe3+,MnO4—,NO3—,Na+,SO42—
⑥酸性溶液中:Fe2+,Al3+,NO3—,I—,Cl—,S2—
A ①②⑤ B ①③⑥ C ②④⑤ D ①②④
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.碳酸钡溶于醋酸溶液:BaCO3+2H+=Ba2++CO2↑+H2O
B.向氯化铝溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
C.在三氯化铁的酸性溶液中通入足量的硫化氢:Fe3++H2S=Fe2++S↓+2H+
D.向饱和碳酸氢钙溶液中加入过量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是: ( )
A.硫酸亚铁加过氧化氢溶液:Fe2+ + H2O2 + 2H+
Fe3+ + 4H2O
B.将少量硝酸银溶液滴入氨水中:Ag+ + 2NH3·H2O
[Ag(NH3)2]+ + 2H2O
C.KAl(SO4)2中滴加Ba(OH)2使SO42-恰好完全沉淀:
2Al3++3 SO42-+3 Ba2++6 OH-=2Al(OH)3↓ +3BaSO4↓
D铝粉与NaOH的溶液反应:2Al + 2OH-
AlO2- + H2↑
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.标准状况下,NA个SO3分子所占的体积约为22.4 L
B.在常温常压下,46 gNO2和N2O4混合物中所含原子的个数为3NA
C.1.8 g重水(D2O)中所含质子的个数为NA
D.7.8 g Na2O2固体中所含阴离子的总数为0.2 NA
难度: 中等查看答案及解析
-
设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
①常温常压下,17g甲基(—14CH3)所含的中子数为9NA
②常温常压22.4L NO气体的分子数小于NA
③64g的铜发生氧化还原反应,一定失去2NA个电子
④常温常压下,100mL 0.5mol/L 的乙酸溶液中,乙酸的分子数目小于0.05NA
⑤标况时,22.4L二氯甲烷所含有的分子数为NA
⑥常温常压下,1mol氦气含有的核外电子数为4NA
A.①② B.③④ C.②④ D.⑤⑥
难度: 中等查看答案及解析
-
在10 L密闭容器中,1 mol A和3 mol B在一定条件下反应:A(g)+xB(g)
2C(g),2min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果不正确的是( )
A.平衡时,物质的量比A∶B∶C=2∶11∶4
B.x值等于4
C.A的转化率20%
D.B的平均反应速率为
难度: 中等查看答案及解析
-
某一密闭容器中充入NO2,在一定条件下进行反应:2NO2(g)
2NO(g)+O2(g)。达到平衡状态的标志是( )
A. NO2的消耗速率与NO的生成速率相等
B. 容器内压强不随时间变化而变化
C. NO和O2的消耗速率之比为2∶1
D. 容器中各组分物质的浓度比为[NO2]:[NO]:[O2]=2:2:1
难度: 中等查看答案及解析
-
在体积不变的密闭容器中,在一定条件下发生下列反应:2A
B(g)+C(s),达到平衡后,升高温度使容器内气体的密度增大,则下列叙述中正确的是( )
A. 若正反应为吸热反应,则A为非气体
B. 若正反应为放热反应,则A为非气体
C. 在平衡体系中加入少量的C,该平衡向逆反应方向移动
D. 改变压强对该平衡的移动无影响
难度: 中等查看答案及解析
-
将1 mol H2(g)和2 mol I2(g)置于某2L密闭容器中,在一定温度下发生如下反应,并达到平衡:H2(g)+I2(g)
2HI(g);ΔH<0。HI的体积分数ω(HI)随时间变化如图(Ⅰ)所示,若改变反应条件,ω(HI)的变化曲线如图(Ⅱ)所示,则改变的条件可能是( )
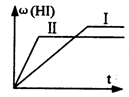
A.恒温条件下,加入适当催化剂
B.恒温条件下,缩小反应容器体积
C.恒容条件下升高温度
D.恒温条件下,扩大反应容器体积
难度: 中等查看答案及解析
-
下列说法中正确的是( )
①晶体中只要有阳离子,就一定有阴离子
②极性分子中肯定含有极性键,则含有极性键的的分子一定是极性分子
③离子化合物一定含有离子键,则共价化合物中一定不含有离子键
④VIIA族单质从上到下,熔沸点越来越高,则IA族单质的熔沸点也越来越高
⑤H2O分子间存在着氢键,故H2O分子比H2S分子稳定
⑥在熔融状态和水溶液中均不能导电的物质称为非电解质
⑦HClO4酸性比H2SO4酸性强,说明氯的非金属性比硫强
A. ①②③⑤ B. ②④⑥ C. ③⑦ D. ①③⑥
难度: 中等查看答案及解析
-
X、Y、Z 三种元素。已知:X+ 和Y-两种离子具有相同的电子层结构;Z元素原子核内质子数比Y元素原子核内质子数少9个,Y和Z两元素可以形成42个电子的负一价阴离子。下列有关说法正确的是( )
A、离子半径:X+>Y-
B、原子序数Y>X>Z
C、X、Y、Z均属于短周期元素
D、X、Y、Z可以形成XYZ、XYZ3、XYZ4等化合物
难度: 中等查看答案及解析
-
在周期表主族元素中,甲元素与乙、丙、丁三元素相邻,甲、乙的原子序数之和等于丙的原子序数;这四种元素原子的最外层电子数之和为20。下列判断中,正确的是
A.原子半径:丙>乙>甲>丁
B.气态氢化物的稳定性:甲>丙
C.最高氧化物水化物的酸性:丁>甲
D.乙和甲或乙和丁所能形成的化合物都是有毒物质
难度: 中等查看答案及解析
-
下表为元素周期表短周期的一部分。下列有关A、B、C、D、E五种元素的叙述中,不正确的是( )
A.A与B形成的阴离子可能有:AB32- 、A2B42-
B.E的氢化物的沸点比C的氢化物的沸点高
C.D在过量的B中燃烧的主要产物为DB2
D.A与E形成的化合物是非极性分子
难度: 中等查看答案及解析
-
下列关于实验现象的描述不正确的是( )
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
难度: 中等查看答案及解析
-
下图A为直流电源,B为浸泡过饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽。接通电路以后发现B上的c点显红色。为实现铁上镀锌,接通K后,使c、d两点短路。下列叙述正确的是( )
A.a为直流电源的负极
B.c极发生的反应为2H++2e—=H2↑
C.f电极为锌板
D.e极发生还原反应
难度: 中等查看答案及解析
-
常温时,纯水电离的c(H+)=a,PH=1的盐酸中由水电离的c(H+)=b,0.2 mol/L的盐酸与0.1mol/L的氢氧化钠溶液等体积混合后,由水电离的c(H+)=c,则a、b、c的关系正确的是( )
A、a﹥b=c B、a﹥c ﹥b C、c ﹥a﹥b D、b﹥ c ﹥a
难度: 中等查看答案及解析
-
常温下,0.1 mol·L-1某一元酸(HA)溶液中
=1×10-8,下列叙述正确的是( )
A.溶液中水电离出的c(H+)=10-10 mol·L-1
B.溶液中c(H+)+c(A-)=0.1 mol·L-1
C.与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中离子浓度大小关系为:c(A-)>c(Na+)>c(OH-)>c(H+)
D.上述溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
难度: 中等查看答案及解析
-
下列溶液中,微粒浓度关系正确的是( )
A.含NH
、Cl-、H+、OH-的溶液,其离子浓度一定是:c(Cl-)>c(NH+4)>c(H+)>c(OH-)
B.pH=7的氨水与氯化铵的混合溶液中,Cl-与NH
的浓度关系:c(Cl-)>c(NH
)
C.0.1 mol·L-1的Na2S溶液中粒子浓度关系:c(OH-)=c(HS-)+2c(H2S)+c(H+)
D.pH=3的一元酸和pH=11的一元强碱等体积混合:c(OH-)=c(H+)
难度: 中等查看答案及解析
-
下列各种情况下,离子或分子浓度大小比较正确的是( )
A.物质的量浓度相等的(NH4)2SO4和(NH4)2SO3溶液中,NH4+浓度:前者大于后者
B.等物质的量浓度的CH3COONa和NaOH溶液中,阴离子总浓度:前者大于后者
C.将氨水和盐酸混合后,所得溶液中可能存在:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.将一定量CO2通入NaOH溶液后,所得溶液中一定存在: c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
难度: 中等查看答案及解析
-
分析有机物的结构应具有的性质是:①缩聚反应 ②加成反应 ③取代反应 ④水解反应 ⑤中和反应 ⑥显色反应 ⑦氧化反应 ⑧还原反应 ⑨消去反应:

A.只③⑤⑥⑦ B.只④⑤⑥⑦
C.全部 D.除①④外其余都有
难度: 中等查看答案及解析
-
将2.3g Na和2.7gAl 同时加入到足量的水中充分反应,将反应后的溶液稀释为500mL。下列说法正确的是( )
A.反应中放出的气体在标准状况下的体积为1.12L
B.稀释、定容操作中用到的全部玻璃仪器有:烧杯、胶头滴管及500mL容量瓶
C.所得溶液中
和
的个数之比一定为1∶1
D.整个反应过程中共转移电子0.4mol
难度: 中等查看答案及解析
-
图示装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用于 ( )
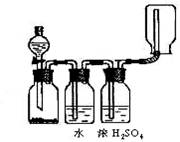
A 锌和盐酸发生氢气
B 二氧化锰和浓盐酸生成氯气
C 碳酸钙和盐酸生成二氧化碳
D 氯化钠和浓硫酸生成氯化氢
难度: 中等查看答案及解析


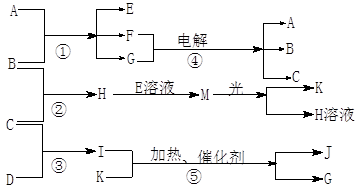
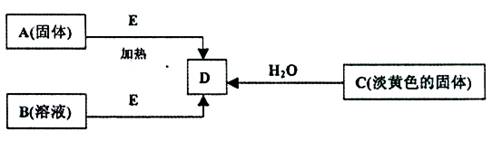


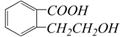 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质: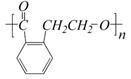 E.
E.