-
最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程示的意图如下:
[Failed to download image : http://qbm-images.oss-cn-hangzhou.aliyuncs.com/QBM/2018/4/13/1923119416934400/1924456457846784/STEM/7dff560aaf77410ea902d0dfc1dd5267.png]
下列说法中正确的是
A. CO和O生成CO2是吸热反应 B. 在该过程中,CO断键形成C和O
C. CO和O生成了具有极性共价键的CO2 D. 状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
难度: 简单查看答案及解析
-
下列有关物质性质与用途具有对应关系的是
A. MnO2不溶于水,可用作H2O2分解的催化剂
B. SO2具有漂白性,可用于制溴工业中吸收Br2
C. FeCl3溶液显酸性,可用于蚀刻铜制的电路板
D. NH4NO3分解产生大量气体,可用作汽车安全气囊产气药
难度: 中等查看答案及解析
-
下列属于酸性氧化物的是( )
A. Mn2O7 B. H2O C. H2O2 D. CO
难度: 简单查看答案及解析
-
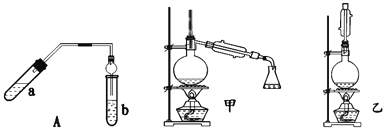
下列仪器可直接加热的是( )
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列物质的水溶液能导电,但属于非电解质的是( )
A. SO2 B. CH3COOH C. KCl D. Cl2
难度: 简单查看答案及解析
-
下列应用中涉及到氧化还原反应的是( )
A. 明矾净化水 B. 纯碱去油污 C. 食醋除水垢 D. 漂白粉漂白织物
难度: 简单查看答案及解析
-
根据酸碱质子理论,能结合质子的化合物为碱,则下列化合物不属于碱的是( )
A. H2O B. NaHCO3 C. NH3 D. NaHSO4
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. Fe(OH)3胶体无色、透明,能发生丁达尔现象
B. H2、SO2、CO2三种气体都可用浓硫酸干燥
C. SiO2既能和氢氧化钠溶液反应也能和氢氟酸反应,所以是两性氧化物
D. SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4
难度: 中等查看答案及解析
-
下列有关化学用语表示不正确的是( )
A. 蔗糖的分子式: C12H22O11 B. HClO的结构式 H-Cl-O
C. 氯化钠的电子式:
D. 二硫化碳分子的比例模型:
难度: 简单查看答案及解析
-
下列说法不正确的是
A. 液晶态介于晶体状态和液态之间,液晶具有一定程度的晶体的有序性和液体的流动性
B. 常压下,0℃时冰的密度比水的密度小,水在4℃时密度最大,这些都与分子间的氢键有关
C. 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化
D. 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. 多孔铂碳不能用于氢氧燃料电池的电极材料
B. 天然气、石油、核能、可燃冰都属于不可再生能源
C. 皂化反应结束后,加入饱和氯化钠溶液,则甘油在下层析出
D. 用玻璃棒蘸取氯水点在湿润的 pH 试纸上,测定该溶液的 pH
难度: 中等查看答案及解析
-
下列关于有机化合物的说法不正确的是( )
A. 聚丙烯酸甲酯中含碳碳双键 B. 以淀粉为原料可制取乙酸乙酯
C. 己烷有5种同分异构体,它们的熔点、沸点各不相同 D. 在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应
难度: 中等查看答案及解析
-
在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表。下列判断不正确的是( )
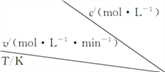
0.600
0.500
0.400
0.300
318.2
3.60
3.00
2.40
1.80
328.2
9.00
7.50
a
4.50
b
2.16
1.80
1.44
1.08
A. a=6.00
B. 同时改变反应温度和蔗糖的浓度,v可能不变
C. b<318.2
D. 不同温度时,蔗糖浓度减少一半所需的时间相同
难度: 困难查看答案及解析
-
下列离子方程式不正确的是( )
A. 向CuSO4溶液中加入Na2O2:2 Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑
B. 离子方程式2Ca2+ + 3HCO3– + 3OH–= 2CaCO3↓ + CO32– + 3H2O可以表示Ca(HCO3)2与NaOH溶液的反应
C. Fe(OH)3溶于HI 溶液: Fe(OH)3+3H+=Fe3++3H2O
D. 向NaAlO2溶液中滴入NaHCO3溶液产生白色沉淀:AlO2-+HCO3-+H2O=Al(OH)3 ↓+CO
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. pH计不能用于酸碱中和滴定终点的判断
B. 实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取
C. 用乙醇和浓H2SO4制备乙烯时,可用水浴加热控制反应的温度
D. 氯离子存在时,铝表面的氧化膜易被破坏,故含盐腌制品不宜直接放在铝制容器中
难度: 中等查看答案及解析
-
下列叙述不正确的是( )
A. 用聚碳酸酯代替聚乙烯塑料可减少白色污染
B. 油脂是热量最高的营养物质,可用于制油漆
C. 氨基酸中只含有一个羧基和一个氨基
D. 纤维素中含有羟基,可以与醋酸酯化生成醋酸纤维
难度: 中等查看答案及解析
-
某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是( )

A. 正极反应为AgCl+e-=Ag + Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
难度: 困难查看答案及解析
-
在不同温度下,水溶液中c(H+)与c(OH-)关系如图所示。下列说法不正确的是 ( )
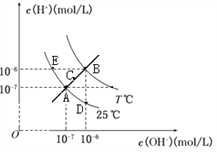
A. 图中五点Kw间的关系:B>C>A=D=E
B. 若从A点到C点,可采用温度不变在水中加入适量NH4Cl的方法
C. E点对应的水溶液中,可能有NH4+、Ba2+、Cl-、I-大量同时存在
D. 若处在B点时,将pH =2的硫酸溶液与pH = 10的KOH溶液等体积混合,所得溶液呈中性
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. 某晶体中含有极性键,则它不可能有很高的熔沸点
B. Na2O、NaOH、Na2S、Na2SO4分别加热熔化,需要克服相同类型作用力
C. 分子间作用力的大小无法决定分子稳定性的高低
D. NaHSO4和NaHCO3两种晶体溶于水时,被破坏的作用既有离子键又有共价键
难度: 中等查看答案及解析
-
下列实验中,所使用的装置(夹持装置略)、试剂和操作方法都正确的是( )
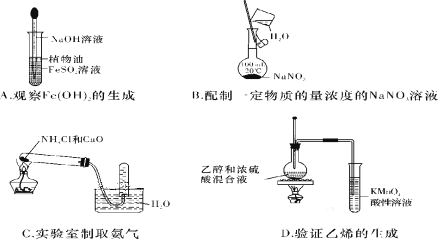
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
用 NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 3mol单质Fe完全转变为Fe3O4,失去8NA个电子
B. 235g核素
发生裂变反应:
+
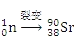 +
++10
,净产生的中子(
)数为10NA
C. 丙醇中存在的共价键总数为10NA
D. 50mL 18.4mol·L-1 浓硫酸与足量铜微热反应,生成 SO2 分子数目为 0.46NA
难度: 中等查看答案及解析
-
40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如下图所示,不正确的是( )
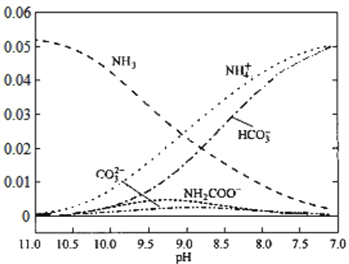
A. 在pH=9.0时,c(NH4+)>c(HCO3ˉ)>c(NH2COOˉ)>c(CO32-)
B. 在氨-水体系中不断通入CO2,体系中始终存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3ˉ)+c(OHˉ)
C. 随着CO2的通入,
不断减小
D. pH=7时,水的电离程度最大
难度: 困难查看答案及解析
-
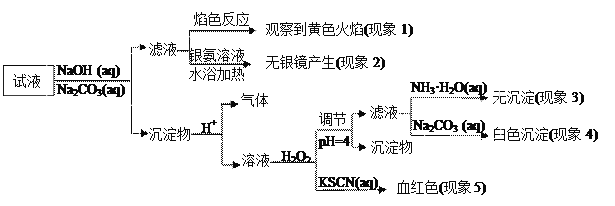
现有一瓶签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验:

已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀。
该同学得出的结论正确的是
A. 根据现象1可推出该试液中含有Na+
B. 根据现象2可推出该试液中并不含有葡萄糖酸根
C. 根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+
D. 根据现象5可推出该试液中一定含有Fe2+
难度: 困难查看答案及解析

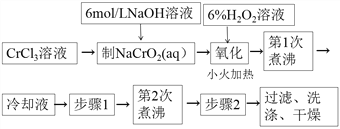
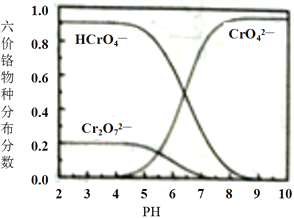
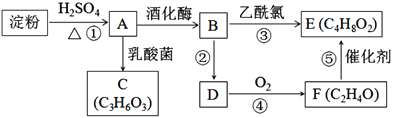
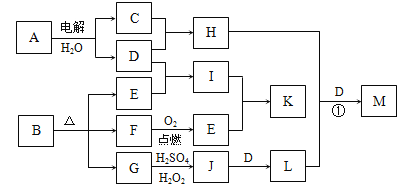
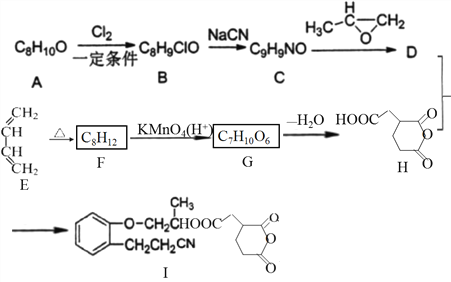
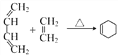
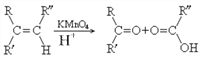
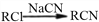
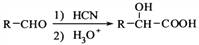 ,写出由
,写出由 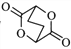 的合成路线流程图(无机试剂任选)。________________
的合成路线流程图(无机试剂任选)。________________