-
北京2008奥运会金牌直径为70mm,厚6mm。某化学兴趣小组对金牌成分提出猜想:甲认为金牌是由纯金制造;乙认为金牌是由金银合金制成;丙认为金牌是由黄铜(铜锌合金)。为了验证他们的猜想,请你选择一种试剂证明甲、乙、丙猜想的正误
A.硫酸铜溶液 B.盐酸 C. 稀硝酸 D. 硝酸银溶液
难度: 中等查看答案及解析
-
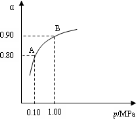
下列数据是对应物质的熔点据此做出的下列判断中错误的是
Na2O
NaCl
AlF3
AlCl3
920
801
1291
190
BCl3
Al2O3
CO2
SiO2
-107
2073
-57
1723
A.铝的化合物的晶体中有的是离子晶体
B.表中只有BCl3和干冰是分子晶体
C.同族元素的氧化物可形成不同类型的晶体
D.不同族元素的氧化物可形成相同类型的晶体
难度: 中等查看答案及解析
-
将几滴KSCN(SCN-是“类卤离子”,与氯离子性质相似)溶液加入酸性的含有Fe3+的溶液中,溶液变成血红色。将该红色溶液分为两份,①一份中加入适量KMnO4溶液,红色褪去;②向另一份中通入SO2,红色也褪去。
下列说法不正确的是
A.①红色褪去的原因可能是KMnO4将SCN-氧化,使[Fe(SCN)]2+消失
B.[Fe(SCN)]2+中Fe3+与SCN-以配位键结合。
C.②红色褪去的原因是SO2具有漂白性
D.SCN-在适当条件下可失去电子被氧化剂氧化为(SCN)2
难度: 中等查看答案及解析
-
下列离子方程式中正确的是
A.向NaAlO2 溶液中通入过量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
B.硫化钠的水解反应:S2-+H3O+
HS-+H2O
C.1 mol/L的KAl(SO4) 2溶液与2 mol/L的Ba(OH) 2溶液等体积混合:Al3++4OH—= AlO2—+2H2O
D.用食醋溶解水垢:2H++CaCO3=Ca2++H2O+CO2↑
难度: 中等查看答案及解析
-
LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能的新宠。已知该电池放电时的电极反应式为:正极 FePO4+Li++e-==LiFePO4 负极 Li-e-== Li+下列说法中正确的是
A.充电时电池反应为FePO4+Li = LiFePO4
B.充电时动力电池上标注“+”的电极应与外接电的正极相连
C.放电时电池内部Li+向负极移动
D.放电时,在正极上是Li+得电子被还原
难度: 中等查看答案及解析
-
将0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10rnL混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是
A.c (Ac-)>c (Cl-)>c (H+)> c (HAc) B.c (Na+)+c (H+)=c (Ac-)+c (Cl-)
C.c (Ac-)=c (Cl-)>c (H+)>c (HAc) D.c (Ac-)>c (Cl-)>c (HAc)>c(H+)
难度: 中等查看答案及解析