-
将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,即构成甲烷燃料电池.已知通入甲烷的一极,其电极反应为:CH4+10OH﹣﹣8e﹣=CO32﹣+7H2O;下列叙述正确的是( )
A. 通入甲烷的一极为正极
B. 通入氧气的一极发生氧化反应
C. 该电池总反应为:CH4+2O2+2OH﹣=CO32﹣+3H2O
D. 该电池在工作时,溶液中的阴离子向正极移动
难度: 困难查看答案及解析
-
下列各组指定原子序数的元素,能形成AB2型离子化合物的是( )
A. 6和8 B. 16和8 C. 12和9 D. 11和6
难度: 简单查看答案及解析
-
有关化学用语正确的是
A. 四氯化碳的电子式:
B. 氢氧根的电子式:
C. 乙烯的结构简式 :CH2CH2 D. 乙醇的结构简式 :CH3CH2OH
难度: 中等查看答案及解析
-
下列反应是吸热反应的是 ( )
A. Fe+ H2SO4 = FeSO4+ H2↑ B. 2Na2O2+2H2O = 4NaOH + O2↑
C. NaOH+HCl=NaCl+H2O D. 2NH4Cl+Ba(OH)2=BaCl2+2NH3↑+2H2O
难度: 简单查看答案及解析
-
下列关于糖类、油脂和蛋白质的性质说法正确的是( )
A. 糖类物质中含C、H、O元素,都有甜味
B. 向淀粉溶液中加入碘水,溶液变蓝
C. 油脂是高分子化合物,热值较大
D. 在蛋白质溶液中加入浓硫酸并微热,可使蛋白质变黄
难度: 简单查看答案及解析
-
青蒿素是抗疟特效药,属于萜类化合物,如图所示有机物也属于萜类化合物,该有机物的一氯取代物有(不考虑立体异构)( )
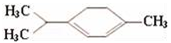
A. 6种 B. 7种 C. 8种 D. 9种
难度: 困难查看答案及解析
-
同周期的X、Y、Z三元素,它们最高价氧化物对应水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是
A. 含氧酸的酸性H3ZO4>H2YO4>HXO4
B. 非金属性X>Y>Z
C. 元素的负化合价的绝对值按X、Y、Z变小
D. 气态氢化物的稳定性按X、Y、Z的顺序增强
难度: 中等查看答案及解析
-
将0.1mol两种气体烃组成的混合气完全燃烧后得3.36L(标况)CO2和3.6g水,对于组成判断正确的是
A. 可能是甲烷和乙烷的混合气体 B. 一定是甲烷和乙烯的混合气体
C. 混合气体中一定没有甲烷 D. 混合气体中一定没有乙烷
难度: 中等查看答案及解析
-
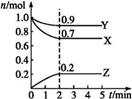
在一定温度下,向一容积固定的密闭容器中充入1 mol N2和3 mol H2反应发生,下列说法正确的是
A. 当混合气体的密度不再改变时,即达到化学平衡。
B. 达到化学平衡时,N2、H2和NH3的物质的量浓度之比为l:3:2。
C. 达到化学平衡时,'容器内混合气体的平均摩尔质量不再变化。
D. 达到化学平衡时,N2和H2的速率关系为:V(N2)=3V(H2)。
难度: 中等查看答案及解析
-
从柑橘中炼制萜二烯
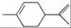 下列有关它的推测,不正确的是( )
下列有关它的推测,不正确的是( )A. 它不能使酸性高锰酸钾溶液褪色
B. 常温下为液态,难溶于水
C. 分子式为C10H16
D. 1mol萜二烯与过量的溴的CCl4溶液反应最多消耗2molBr2
难度: 简单查看答案及解析
-
下列事实不能用勒夏特列原理解释的是( )
A. 溴水中有下列平衡Br2+H2O
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
B. 合成氨是放热反应,为提高氨的产率,理论上应采取降低温度的措施
C. 反应CO(g)+NO2(g)
CO2(g)+NO(g) ΔH<0,达到平衡后,升高温度体系颜色变深
D. 对于2HI(g)
H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
难度: 中等查看答案及解析
-
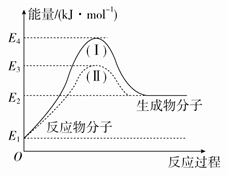
已知反应① 2C(s)+O2(g)="2CO(g)" △H=-221KJ/mol;②稀溶液中,H+(aq)+OH—(aq)=H2O(l) △H=-57.3KJ/mol;下列结论正确的是
A. 碳的燃烧热为110.5kJ/mol
B. 2molC(s)和1molO2(g)的能量比2molCO(g)的能量高221kJ
C. 含0.5 molH2SO4的浓硫酸与含1 molNaOH的溶液混合,产生57.3kJ热量
D. 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3kJ热量
难度: 中等查看答案及解析
-
如图所示是Zn(原子量为65)和Cu形成的原电池,下列描述合理的是( )
①Zn为负极,Cu为正极 ②Cu极上有气泡产生
③阳离子移向Zn极 ④电子从Zn极流出沿导线流向Cu极
⑤该装置能将电能转化为化学能
⑥若有0.5mol电子流经导线,则负极质量减轻32.5g
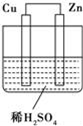
A. ①②④ B. ②③ C. ④⑤⑥ D. ③④⑤
难度: 中等查看答案及解析
-
如图所示装置中,观察到电流计指针偏转,M棒变粗,N棒变细。由此判断下表中所列M、N、P物质,其中成立的是( )
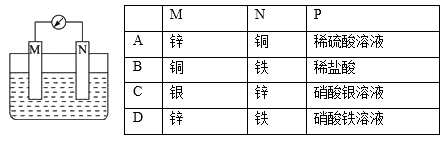
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
反应C(s)+H2O(g)⇌CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加C的量 ②将容器的体积缩小一半
③保持体积不变,充入N2④保持压强不变,充入N2.
A. ①④ B. ①③ C. ③ D. ②③
难度: 中等查看答案及解析
-
已知:Na2S2O3+H2SO4= S↓+SO2↑+H2O+ Na2SO4,通过析出硫的快慢可以说明反应速率的大小,请判断下列几种情况下,最先看到硫析出的是
选项
温度
Na2S2O3溶液的体积和物质的量浓度
H2SO4的体积和物质的量浓度
A
20℃
15mL0.1mol·L-1
15mL0.1mol·L-1
B
20℃
10mL0.2mol·L-1
10mL0.2mol·L-1
C
50℃
50mL0.1mol·L-1
50mL0.1mol·L-1
D
50℃
5mL0.5mol·L-1
5mL0.5mol·L-1
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
分子式符合C4H10O且能与金属钠反应生成氢气的有机物的同分异构体有( )
A. 2种 B. 3种 C. 4种 D. 5种
难度: 中等查看答案及解析
-
金属钛(Ti)性能优越,钛被称为“第三金属”(铁、铝分为第一、二金属),工业以TiO2冶炼Ti的主要反应有:①TiO2+2C+2Cl2
TiCl4+2CO ②TiCl4+2Mg
2MgCl2+Ti下列叙述正确的是( )
A. 反应①是置换反应 B. 反应②是复分解反应
C. 反应①中TiO2是氧化剂 D. 反应②中金属镁是还原剂
难度: 简单查看答案及解析
-
下列除去杂质(括号内物质为少量杂质)的方法中,正确的是( )
A. 乙烷(乙烯):光照条件下通入Cl2,气液分离
B. 乙酸乙酯(乙酸):用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏
C. CO2(SO2):气体通过盛氢氧化钠溶液的洗气瓶
D. 乙醇(乙酸):加足量浓硫酸,蒸馏
难度: 中等查看答案及解析
-
甲烷分子中的4个氢原子全部被苯基取代,可得如图所示的分子,对该分子的描述正确的是
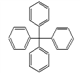
A. 此物质属于芳香烃,是苯的同系物
B. 所有碳原子可能在同一平面上
C. 常温下此分子为气态
D. 分子式为C25H20
难度: 中等查看答案及解析
-
下图是可逆反应X2+ 3Y2
2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是:
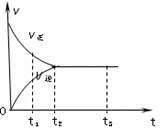
A. t1时,只有正方向反应
B. t2时,反应未到达最大限度
C. t2- t3,反应不再发生
D. t2- t3,各物质的浓度不再发生变化
难度: 中等查看答案及解析
-
已知反应:2X(g)+Y(g)
2Z(g)。某研究小组将4 mol X和2 mol Y置于一容积不变的密闭容器中,测定不同时间段内X的转化率,得到如下表数据:
t(min)
2
4.5
5
6
X转化率
30%
40%
70%
70%
根据以上信息作出的下列判断中正确的是( )
A. 随着反应的进行,混合气体的密度不断增大
B. 反应在5.5 min时,v正(X)=v逆(Z)
C. 6 min时,容器中剩余1.4 mol Y
D. Y的转化率小于70%
难度: 中等查看答案及解析
-
沼气是一种能源,它的主要成分是CH4。0.5 mol CH4完全燃烧生成CO2和液态水时放出445 kJ的热量,则下列热化学方程式中正确的是( )
A. 2CH4(g)+4O2(g)==2CO2(g)+4H2O(l) ΔH=+890 kJ·mol-1
B. CH4(g)+2O2(g)==CO2(g)+2H2O(l) ΔH=+890 kJ·mol-1
C. CH4(g)+2O2(g)==CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
D. 1/2CH4(g)+O2(g)==1/2CO2(g)+H2O(l) ΔH=-890 kJ·mol-1
难度: 中等查看答案及解析
-
化学与人类生活、社会可持续发展密切相关。下列措施有利于节能减排、保护环境的是
①加快化石燃料的开采与使用
②研发易降解的生物农药
③应用高效洁净的能源转化技术
④田间焚烧秸秆
⑤推广使用节能环保材料
A. ①③⑤ B. ②③⑤ C. ①②④ D. ②④⑤
难度: 中等查看答案及解析