-
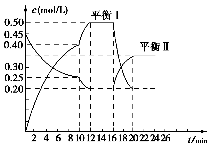
在25 ℃时,密闭容器中X、Y、Z三种气体的浓度变化情况如图,下列说法错误的是( )。
A.反应可表示为3X+Y
2Z
B.从反应开始到0.4 s时,以Y表示的化学反应速率为0.25 mol·L-1·s-1
C.增大压强使平衡向生成Z的方向移动,正逆反应速率均增大
D.升高温度,平衡常数一定增大
难度: 中等查看答案及解析
-
对于可逆反应:4NH3(g)+5O2(g)
4NO(g)+6H2O(g),下列叙述正确的是 ( )。
A.反应达到平衡时,若两种反应物的转化率相等,则起始投入的n(NH3)∶n(O2)=4∶5
B.反应达到平衡时,对体系充入稀有气体并加压,平衡总是向逆反应方向移动
C.反应达到平衡时,若向压强固定的密闭容器中充入稀有气体,平衡不移动
D.当v正(NH3)∶v正(NO)=1∶1时,说明该化学反应已经达到平衡
难度: 中等查看答案及解析
-
利用醋酸二氨合铜[Cu(NH3)2Ac]溶液吸收CO,能达到保护环境和能源再利用的目的,反应方程式为Cu(NH3)2Ac+CO+NH3
[Cu(NH3)3]Ac·CO。已知该反应的化学平衡常数与温度的关系如表所示:
温度/℃
15
50
100
化学平衡常数
5×104
2
1.9×10-5
下列说法正确的是 ( )。
A.上述正反应为吸热反应
B.15 ℃时,反应[Cu(NH3)]Ac·CO
Cu(NH3)2Ac+CO+NH3的平衡常数为0.5
C.保持其他条件不变,减小压强,CO的转化率减小
D.醋酸二氨合铜溶液的浓度大小对CO的吸收没有影响
难度: 中等查看答案及解析
-
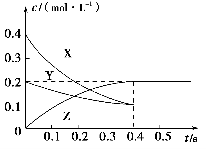
一定条件下,向容积为2 L的密闭容器中充入1 mol CO2和3 mol H2,发生如下反应:CO2(g)+3H2(g)
CH3OH(g)+H2O(g),5 min后反应达到平衡时c(CH3OH)为0.2 mol·L-1。CO2(g)的平衡物质的量浓度c(CO2)与温度关系如图所示。下列说法错误的是( )。

A.0~5 min,CO2的平均反应速率为0.04 mol·(L·min)-1
B.反应CO2(g)+3H2(g)
CH3OH(g)+H2O(g)的ΔH<0
C.在T2 ℃时,若反应处于状态D,则一定有v正<v逆
D.若T1 ℃、T2 ℃时的平衡常数分别为K1、K2,则K1>K2
难度: 中等查看答案及解析
-
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g)
MgO(s)+CO2(g)+SO2(g) ΔH>0;该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )。
选项 x y
A 温度 容器内混合气体的密度
B CO的物质的量 CO2与CO的物质的量之比
C SO2的浓度 平衡常数K
D MgSO4的质量(忽略体积) CO的转化率
难度: 困难查看答案及解析
-
在我国汽车尾气已成为主要的大气污染物,使用稀土等催化剂能将汽车尾气中的CO、NOx和碳氢化合物转化成无毒物质,从而减少污染。向容积相同的两个密闭容器内(装有等量的某种催化剂),分别充入等量的NOx及C3H6,在不同温度下,发生如下反应:
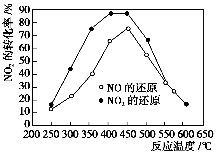
①18 NO(g)+2C3H6(g)
9N2(g)+6CO2(g)+6H2O(g);
②18 NO2(g)+4C3H6(g)
9N2(g)+12 CO2(g)+12 H2O(g)
分别测定不同温度时NOx的转化率,所得的曲线如图所示。下列说法正确的是( )。
A.该反应的ΔH>0
B.加入催化剂,NO(g)的转化率比NO2(g)的低
C.分离出H2O(g)可提高碳氢化合物的转化率
D.增大C3H6(g)的浓度可提高NOx的转化率,具有实际意义
难度: 中等查看答案及解析
-
900 ℃时,向2.0 L恒容密闭容器中充入0.40 mol乙苯,发生反应:
 ΔH=a kJ·mol-1。经一段时间后达到平衡。反应过程中测定的部分数据见下表:
ΔH=a kJ·mol-1。经一段时间后达到平衡。反应过程中测定的部分数据见下表:时间/min
0
10
20
30
40
n(乙苯)/mol
0.40
0.30
0.24
n2
n3
n(苯乙烯)/mol
0.00
0.10
n1
0.20
0.20
下列说法正确的是( )。
A.反应在前20 min的平均速率为v(H2)=0.008 mol·L-1·min-1
B.保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08 mol·L-1,则a<0
C.保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率为50.0%
D.相同温度下,起始时向容器中充入0.10 mol乙苯、0.10 mol苯乙烯和0.30 mol H2,达到平衡前v正>v逆
难度: 中等查看答案及解析
-
在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g)
zC(g),图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。

A.200 ℃时,反应从开始到平衡的平均速率v(B)=0.02 mol·L-1·min-1
B.由图乙可知,反应xA(g)+yB(g)zC(g)的ΔH<0,且a=2
C.若在图甲所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200 ℃时,向容器中充入2 mol A和1 mol B,达到平衡时,A的体积分数小于0.5
难度: 困难查看答案及解析